干细胞治疗糖尿病又有新突破!瑞普晨创在Nature Metabolism发布胰岛移植新策略
转自:中国经济周刊
中国经济周刊-经济网讯全球糖尿病治疗又有新的突破性研究成果,这一新成果来自于中国知名的科研机构、医疗机构和生物医药研发企业的一次重要合作。
2023年1月9日,北京大学邓宏魁研究组、中国医学科学院/北京协和医学院彭小忠研究组、瑞普晨创研发团队合作在全球顶级科学杂志NatureMetabolism上,发表题为Implantationunderneaththeabdominalanteriorrectussheathenableseffectiveandfunctionalengraftmentofstemcell-derivedislets(腹直肌前鞘下支持人多能干细胞分化胰岛细胞的高效定植和发挥功能)的研究论文。
这一新的研究成果的核心是:开发了一个全新的胰岛移植策略,有效支持人多能干细胞分化的胰岛细胞在体内存活、功能成熟以及功能长期维持。相较于传统的胰岛移植策略,该方案的先进性和优势是,创伤小、操作简便、移植物易于长期追踪观察;更重要的是,多能干细胞分化的胰岛细胞使用该方案移植到体内,细胞功能显著优于临床常用的移植方案。

糖尿病是全球范围内威胁人类健康的重大疾病之一。当前常用的治疗方法由于难以实现血糖的精准调控,导致多种并发症发生,严重影响患者的生活质量,甚至会危及生命。
胰岛移植,是目前治疗糖尿病的前沿技术和方案。对于胰岛素依赖型糖尿病患者来说,胰岛移植可以使患者完全脱离胰岛素注射,实现疾病治愈,是糖尿病治疗的理想途径。但是,由于胰岛移植依赖的人胰岛组织供体极其稀缺,致使该治疗策略和方案难以被广泛应用。
人多能干细胞因具有无限增殖和分化为胰岛细胞的潜能,被寄予成为解决糖尿病治愈难题的希望。
利用人多能干细胞治疗1型糖尿病,需要解决三个关键问题:如何获得人多能干细胞?如何将人多能干细胞诱导分化为胰岛细胞?如何将胰岛细胞移植到体内?
2022年,北京大学干细胞中心邓宏魁研究组建立了一种安全、简单、易于调控和标准化的人多能干细胞制备技术,即化学重编程技术,完全使用小分子诱导人成体细胞转变为多能干细胞(hCiPSC)(Nature,2022)。随后,瑞普晨创与北京大学干细胞中心、中国医学科学院医学生物研究所及天津市第一中心医院器官移植中心合作开展研究,进一步将hCiPSC定向诱导分化生成胰岛细胞(hCiPSC-islets),并在非人灵长类动物模型中展示了hCiPSC-islets应用于1型糖尿病治疗的安全性和有效性(NatureMedicine,2022)。
在解决了人多能干细胞来源和定向分化两个难题后,关键瓶颈是如何高效的将多能干细胞分化的胰岛细胞移植回体内、长期发挥功能。
临床常用的胰岛细胞移植策略是肝门静脉移植,移植后胰岛长期定植于肝脏内。2000年,加拿大阿尔伯塔大学Shapiro团队建立埃德蒙顿方案(Edmontonprotocol),使接受胰岛移植的1型糖尿病患者,完全脱离外源胰岛素注射,血糖恢复至正常水平,实现了疾病的治愈。但肝脏门静脉内移植存在较高的出血和凝血风险;更严重的是,胰岛移植早期会发生即刻炎性反应,导致胰岛细胞大量死亡。同时,移植后的胰岛弥散分布于肝脏中,难以追踪观察,且不能被移除。这些安全性和有效性方面的问题使胰岛移植迫切需要一种更理想的移植方案。
也就是说,开发细胞存活率高、安全性好、有利于人多能干细胞分化的胰岛细胞功能成熟和长期维持的移植方案,是人多能干细胞分化的胰岛临床转化迫切需要解决的科学难题。
来自中国的研究团队率先给出了解决这一科学难题的最新策略和方案。2023年1月9日,北京大学邓宏魁研究组、中国医学科学院/北京协和医学院彭小忠研究组、瑞普晨创研发团队合作在全球权威的学术期刊NatureMetabolism上发表的科学论文显示,该研究团队建立了一个全新的移植策略:腹直肌前鞘下移植。
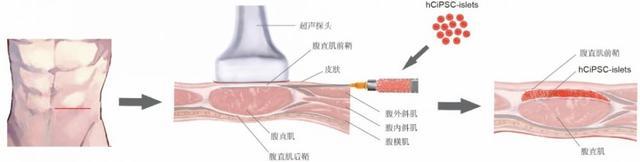
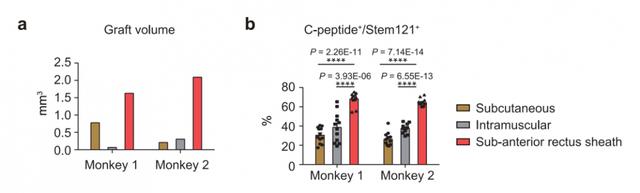
这一全新的移植策略和方案的突破性何在?相较于门静脉内移植,腹直肌前鞘下移植优势明显。首先,手术方案安全、易行,在B超引导下即可完成移植,移植过程无出血和凝血风险。其次,移植物被局限在腹直肌前鞘下的特定的空间,通过影像学手段可以对移植物进行监测和控制(图1)。相较于其它腹腔外移植方案(皮下移植和肌肉内移植),腹直肌鞘下移植能够有效的支持人多能干细胞分化胰岛细胞的早期细胞存活和长期功能维持(图2)。
该论文内容显示,研究者将hCiPSC-islets输注到糖尿病模型猴腹直肌前鞘下,所有接受移植的糖尿病猴的血糖控制都得到了显著改善(图3)。从移植后第6周开始,空腹血糖、餐前血糖以及餐后2小时血糖下降至10mM以下。移植后12周,糖化血红蛋白(HbA1c)平均下降44%,到达健康猴水平;同时,外源胰岛素输注量下降43%。
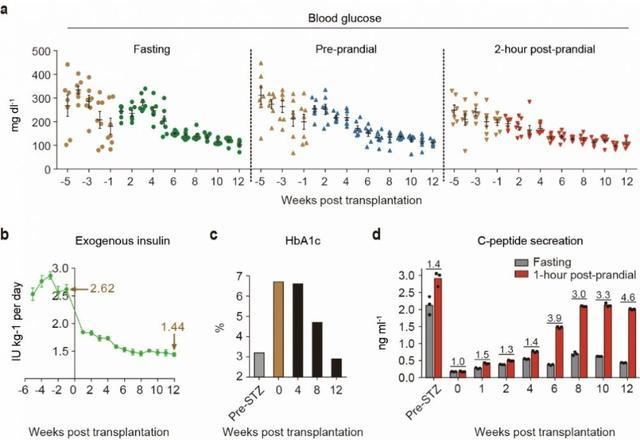
研究人员还证实,hCiPSC-islets移植后,内源胰岛素分泌水平大幅提升,且能够响应血糖浓度变化;与肝脏门静脉移植相比,新移植方案胰岛素标志物(C肽)分泌水平提升5倍以上,其中一只糖尿病猴C肽分泌水平达到了健康人的水平。这个结果表明,未来在人多能干细胞分化胰岛细胞临床移植中,接受腹直肌鞘下移植有望使糖尿病患者完全脱离胰岛素注射,实现1型糖尿病的治愈。
综上所述,该研究证明腹直肌前鞘下移植是一种适于人多能干细胞分化胰岛的移植的全新移植策略。其操作方法简单,移植相关不良反应少,移植后多能干细胞分化胰岛细胞高效存活、在体内逐渐获得成熟功能并长期稳定地维持其生理功能。这些优点使腹直肌鞘下移植成为未来人多能干细胞用于临床糖尿病治疗理想的移植策略。这个移植策略也可能被广泛用于其它多种类型的细胞的移植。
北京大学邓宏魁教授、瑞普晨创杜媛媛博士、中国医学科学院/北京协和医学院彭小忠教授为论文共同通讯作者。瑞普晨创梁振博士为本论文的共同第一作者之一。这项研究得到了国家自然科学基金、生命科学联合中心和浙江省“领雁”计划的支持。
瑞普晨创全称为杭州瑞普晨创科技有限公司,是国内知名的尖端生物医学研发企业,专注于干细胞再生医学这一国际领先顶尖生物医学领域。瑞普晨创拥有一支整体实力强、专业设置齐全、临床资源丰富的研发技术团队。技术团队带头人为癌症靶向治疗领域十年磨一剑的丁列明博士和国际干细胞生物学会理事会理事、长江学者特聘教授邓宏魁博士,团队聚集了国内顶尖学府的优秀硕博精英。瑞普晨创以干细胞治疗糖尿病为切入口,建立符合国际标准的干细胞治疗临床转化产品平台,开发国际领先的干细胞定向分化治疗产品。瑞普晨创研发或参与研发的多项有关干细胞治疗糖尿病的科研成果,之前已先后在国际知名的Nature、NatureMedicine等医学科学杂志发表。(资料来源:瑞普晨创官方微信)
