基于RNA测序分析中国人群MET 14号外显子跳跃突变的发生率及其与PD-L1表达相关性
转自:医学界
间充质-上皮转化(MET)14号外显子跳跃突变(MET14跳突)是一种独特的非小细胞肺癌(NSCLC)驱动基因变异。临床上,MET14号外显子跳跃突变最常见的检测方法是DNA测序。然而,由于一些不包含MET14号外显子剪接点的体细胞变异也可能导致MET14跳突。因此,RNA测序才是检测MET14跳突最准确的方法。有研究者基于RNA测序分析了中国人群MET14跳突的发生率及其PD-L1表达情况的相关性,本文对此进行解读和分享。
背景
NSCLC约占所有肺癌的85%,其中腺癌(ADC)和鳞状细胞癌(SCC)是NSCLC最常见的组织亚型,分别占50%和30%[1]。近期,MET基因的激活突变逐渐被公认为NSCLC的潜在治疗靶点。MET是一种受体酪氨酸激酶,当与肝细胞生长因子(HGF)配体结合时被激活,形成同源二聚体,随后激活激酶结构域。这个过程可触发下游信号通路级联反应,促进肿瘤细胞增殖、细胞周期进展、迁移和侵袭。MET的异常激活还可触发下游PI3K/AKT/mTOR和RAS/ERK/MAPK通路的结构性激活,参与肿瘤的发生和发展[2]。
MET14跳突已被证实是NSCLC治疗靶点,在TCGA数据库肺ADC中发生率为4.3%[3]。MET14跳突可导致E3泛素蛋白连接酶(CBL)有效结合所必需的膜旁区域缺失,导致MET的稳定性和致癌潜力增加,并增加了对MET酪氨酸激酶抑制剂(TKI)的敏感性[4]。MET14跳突在台湾NSCLC患者发生率约为4.0%,香港为2.6%,中国大陆为0.9%,韩国为2.13%,美国为2.1%-3%[4-6]。MET14跳突发生率的差异可能与检测方法学、标本来源和种族差异有关。在本研究中,研究者使用基于靶向RNA的下一代测序(NGS)检测了951例中国NSCLC患者MET14号外显子的变异情况。此外,在这些患者中,NSCLC其他主要驱动基因突变和PD-L1表达情况也被一并分析。
研究结果
本研究共纳入951例NSCLC患者,其临床特征总结如表1所示。入组患者的中位年龄为63岁,男性占55.3%(526/951)。吸烟史方面,51.1%(454/888)的患者从不吸烟,48.9%(434/888)曾经吸烟(63例资料缺失)。组织学亚型主要为ADC(81.2%,772/951)和SCC(15.9%,151/951)。其他组织学亚型包括腺鳞癌(ASC,1.2%,11/951)、大细胞癌(LCC,0.7%,7/951)、肉瘤样癌(SC,0.4%,4/951)和粘液表皮样癌(MEC,0.1%,1/951)。可获取病理分期信息的608例患者中,I期占17.3%(105/608),II期占4.4%(27/608),III期占16.4%(100/608),IV期占61.9%(376/608)。
表1.入组患者的基线特征
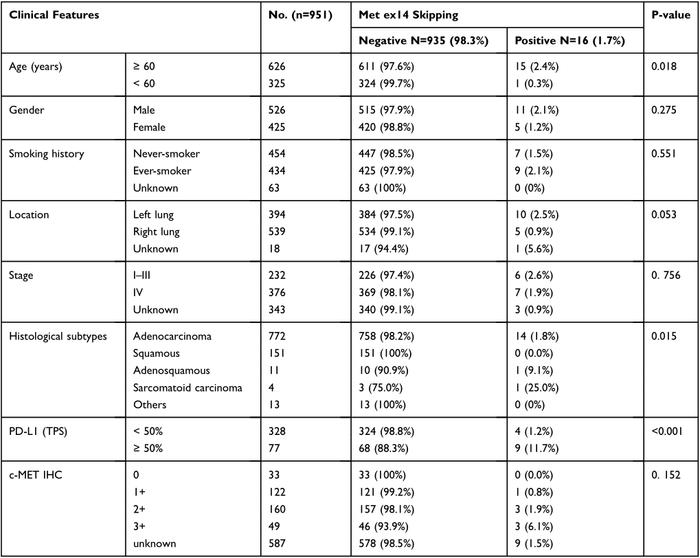
检测到16例MET14跳突,占NSCLC患者总数的1.7%(16/951)(图1A)。其中ADC14例(87.5%),ASC1例(6.3%),SC1例(6.3%)。本研究未在SCC或其他组织学类型检测发现MET14跳突。ADC和非鳞NSCLC的发生率分别为1.8%(14/772)和2.0%(16/800)。在本研究中,肿瘤标本是通过三种不同的方法获得的:手术切除、经皮肺活检(PTNB)和经支气管镜肺活检(TBLB)。NSCLC手术切除标本中MET14跳突的检出率为2.3%(8/344),在ADC中为2.0%(6/307)(图1A)。951例NSCLC患者驱动基因突变情况如图1所示:EGFR突变444例(46.7%),KRAS突变99例(10.4%),ALK重排52例(5.5%),ERBB2突变31例(3.3%),BRAF突变18例(1.9%),ROS1重排13例(1.4%),ERBB4突变12例(1.3%),RET重排10例(1.1%)。也在ADC人群中评估了基因改变的比例(图1,左图)。与总体NSCLC患者相比,ADC中EGFR突变和ALK重排的比例略高。
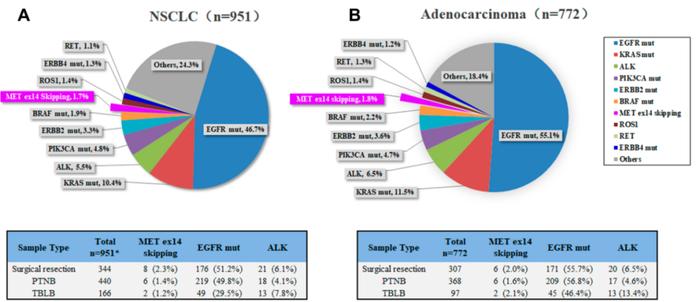
表1展示了16例携带MET14跳突的患者临床病理特征。除1例患者(59岁)外,其余均>60岁。MET14跳突NSCLC患者与其他驱动基因突变NSCLC患者的中位年龄有显著差异,如ALK(66vs54,P=0.001)和ROS1(66vs59,P=0.010;图2A),表明MET14跳突患者比其他驱动基因突变患者年龄更大。此外,MET14跳突和野生型患者中,性别和从不吸烟的比例没有显著差异。未发现MET14跳突与肿瘤原发灶位置和分期之间存在显著的关联(图2B和C)。
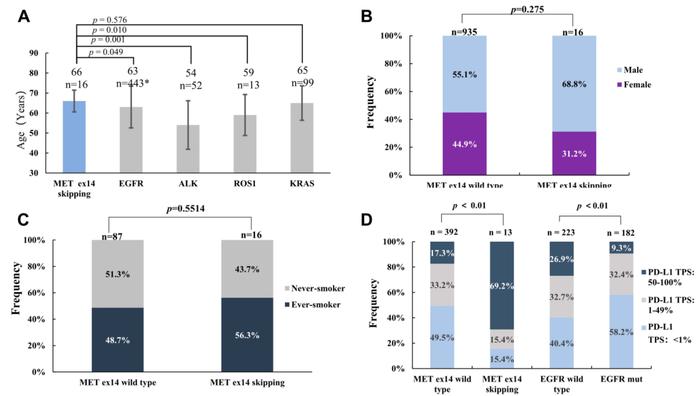
图2.MET14跳突患者的临床特点。(A)具有不同驱动基因突变的患者中位年龄。(B)MET14跳突和野生型群体的性别比例。(C)MET14跳突和野生型群体的吸烟史比较。(D)PD-L1在MET14跳突、MET14野生型、EGFR突变和EGFR野生型群体中的表达状况。
共有364例患者进行了c-MET免疫组化(IHC)检测并归入c-MET队列。根据染色强度(阴性、弱、中、强)和肿瘤细胞的阳性率,c-MET队列中的患者被分为4个亚组:3+(n=49,13.5%)、2+(n=160,44.0%)、1+(n=122,33.5%)和0(n=33,9.0%)。c-MET队列有MET14跳突患者7例,3例(42.9%)评分为3+,3例(42.9%)评分为2+,1例(14.2%)评分为1+。MET14跳突、MET14野生型患者中分别有85.7%(6/7)和56.9%(203/357)的NSCLC患者出现MET过表达,卡方检验显示两组间无显著差异(P=0.253)。
当有足够的组织标本时,研究者使用IHC评估PD-L1的表达状态。采用肿瘤比例评分(TPS)评价PD-L1蛋白的表达情况。在401例接受PD-L1表达检测的患者中,PD-L1阴性(1%本队列中有13例携带MET14跳突的患者,其中PD-L1高表达9例(69.2%),PD-L1低表达或阴性4例(30.8%)(表1)。MET14跳突和MET14野生型患者PD-L1表达状态差异有统计学意义,携带MET14跳突的NSCLC患者PD-L1倾向于高表达(69.2%vs17.3%,P<0.01)。相反,与EGFR野生型患者相比,EGFR突变患者PD-L1高表达的比例显著更低(9.3%比26.9%,P<0.01;图2D)。
基于DNA和RNA的NGS被用于识别肺癌相关基因改变,包括融合、截断、框内突变和错义突变。在16例MET14跳突患者中,1例EGFR外显子19缺失,突变丰度低(EGFRc.2240_2257del,1.41%)。其他常见致癌驱动基因如KRAS、ALK、ROS1、RET等均未发现与MET14跳突相关的突变。在EGFR/KRAS/ALK/ROS1/RET野生型NSCLC患者中,MET14跳突检出率为4.7%(16/340)。作为一种主要的抑癌基因,TP53共突变在驱动基因突变阳性人群中广泛存在。在本研究中,48%(444/935)的NSCLC患者检测到TP53突变,其中46.2%(205/444)携带EGFR突变,49.5%(49/99)携带KRAS突变,21.2%(11/52)携带ALK重排,38.5%(5/13)携带ROS1重排,20%(2/10) 携带RET重排。在MET14跳突和野生型患者中,TP53共突变的比例分别为37.5%(6/16)和47.5%(444/935),两组间差异无统计学意义。
结论
根据基于RNA的NGS评估结果,东亚人群肺ADCMET14跳突的发生率与西方人群相近。MET14跳突NSCLC患者年龄大于其他驱动基因突变患者,如EGFR、ALK和ROS1。此外,PD-L1倾向于在MET14跳突NSCLC患者中高表达。
本文主要参考
[1]XuZ,LiH,DongY,etal.IncidenceandPD-L1ExpressionofMET14SkippinginChinesePopulation:ANon-SelectiveNSCLCCohortStudyUsingRNA-BasedSequencing.OncoTargetsTher.2020;13:6245-6253.Published2020Jun30.doi:10.2147/OTT.S241231。
其他参考文献:
[1]HirschFR,ScagliottiGV,MulshineJL,etal.Lungcancer:currenttherapiesandnewtargetedtreatments.Lancet(London,England).2017;389(10066):299-311.
[2]SadiqAA,SalgiaR.METasapossibletargetfornon-small-celllungcancer.Journalofclinicaloncology:officialjournaloftheAmericanSocietyofClinicalOncology.2013;31(8):1089-1096.
[3]Comprehensivemolecularprofilingoflungadenocarcinoma.Nature.2014;511(7511):543-550.
[4]FramptonGM,AliSM,RosenzweigM,etal.ActivationofMETviadiverseexon14splicingalterationsoccursinmultipletumortypesandconfersclinicalsensitivitytoMETinhibitors.Cancerdiscovery.2015;5(8):850-859.
[5]AwadMM,OxnardGR,JackmanDM,etal.METExon14MutationsinNon-Small-CellLungCancerAreAssociatedWithAdvancedAgeandStage-DependentMETGenomicAmplificationandc-MetOverexpression.Journalofclinicaloncology:officialjournaloftheAmericanSocietyofClinicalOncology.2016;34(7):721-730.
[6]SchrockAB,FramptonGM,SuhJ,etal.Characterizationof298PatientswithLungCancerHarboringMETExon14SkippingAlterations.Journalofthoraciconcology:officialpublicationoftheInternationalAssociationfortheStudyofLungCancer.2016;11(9):1493-1502.
受众声明:本材料由阿斯利康提供,仅供医疗卫生专业人士参考。
审批编号:CN-124368 过期日期2024-11-14
