遭7家仿制药企进攻,原研药“躲”过集采,药企专利之战的围剿与反围剿 氢溴酸伏硫西汀片在中国市场命途多舛
来源:E药经理人
贯穿药品全生命周期的专利制度已逐步完善,仿制药企未来将怎样发起专利挑战?
两次医保谈判失败,被“调出”第八批集采的名单,7家仿制药虎视眈眈,氢溴酸伏硫西汀片在中国市场的日子,可以用“命途多舛”来形容。
仿制药“围攻”,原研药“应战
氢溴酸伏硫西汀片是由丹麦灵北制药和日本武田制药联合研发的抗抑郁类药物,2013年9月,氢溴酸伏硫西汀片获美国FDA批准上市,用于重型抑郁症(MDD)的治疗。2017年,该产品获批进入中国。作为一款明星级别的抗抑郁药,氢溴酸伏硫西汀片已跻身重磅炸弹之列,2021年全球销售额超过10亿美元。
进入中国市场后,氢溴酸伏硫西汀片持续放量。根据米内网的数据,2020年,氢溴酸伏硫西汀片在中国城市实体药店终端的抗抑郁药销售额TOP10中涨幅第一,同比增长240%。到了2021年,中国公立医疗机构终端数据显示,该产品的销售额接近1.3亿元。
巨大的市场也让仿制药“闻讯赶来”,尤其是在“确认”氢溴酸伏硫西汀片化合物专利会在2022年10月2日到期后。正大天晴的氢溴酸伏硫西汀片是最早获批的,于2021年7月20日成为了国内首仿。到今年3月初《全国药品集中采购文件(GY-YD2023-1)》发布前,国内氢溴酸伏硫西汀片的过评企业已增长至7家,包括倍特药业、康弘药业、石药集团欧意药业、豪森药业、以岭万洲国际制药与扬子江药业。
仿制与原研7+1的竞争格局,可以说氢溴酸伏硫西汀片被集采几乎是“板上钉钉”了,为何此次被“踢”出最终版采购文件?原因或许出自专利上。
虽然氢溴酸伏硫西汀片化合物专利已经到期,但其晶型的专利保护期还将持续至2027年。据了解,此专利保护了游离晶体碱、α型氢溴酸盐、β型氢溴酸盐、γ型氢溴酸盐、氢溴酸盐半水合物、乙酸乙酯溶剂化合物与α型氢溴酸盐的混合物、盐酸盐、盐酸盐一水合物、甲磺酸盐、富马酸盐、马来酸盐、内消旋酒石酸盐、L-(+)-酒石酸盐、D-(-)-酒石酸盐、硫酸盐、磷酸盐、硝酸盐。风云药谈创始人张廷杰表示,调出名单的原因或许与晶型专利保护的问题有关。他具体解释道,虽然有国内企业已经发起了专利无效的挑战,但只有一小部分晶型挑战成功,绕开了原研药的专利,而其他企业的产品仍在灵北的专利期内。
灵北制药的原研产品目前在国内市场具有绝对的主导地位,2021年与2022年的两次医保目录调整中该产品均无缘。对一众虎视眈眈的仿制药企业来说,集采正是他们快速分得市场蛋糕的机会,只不过,如今来看,想通过集采以价换量的这条路还有专利这只拦路虎。
事实上,近年来原研药企业与仿制药企业之间的专利侵权纠纷数量明显增加,双方也“各有胜负”,守住自家“明星”原研药的专利与现有市场,对MNC来说愈发重要。如2022年11月2日,上海医药集中招标采购事物管理所就曾发布“暂停广东东阳光药业有限公司生产利格列汀片(规格为5mg×7片/板×1板/盒)采购资格的通知”,并表示,此举在于做好医药招标采购领域的知识产品产权保护工作。
这就不得不提利格列汀片的原研公司勃林格殷格翰与广东东阳光药业之间的专利之争。
降糖药利格列汀片于2013年4月在中国获批上市,其化合物专利将在2023年到期、晶形专利则会在2027年到期。不过早在2020年7月,广东东阳光药业便拿下利格列汀片的首仿,很快在多个省(区、市)的药品采购平台挂网,并在部分地区开始实际销售利格列汀产品。
原研企业勃林格殷格翰认为东阳光对其利格列汀仿制药制造、销售的行为侵犯了多件药品专利权,因此提起侵害发明专利权诉讼,同时向国家知识产权局提出重大专利侵权纠纷行政裁决请求。这起案件在去年的8月宣判,国家知识产权局判定东阳光侵犯了勃林格殷格翰的一项保护利格列汀化合物的专利,责令被请求人东阳光药业立即从已挂网的药品采购平台撤回被控侵权制剂利格列汀片的挂网并立即停止制造、销售、许诺销售侵犯请求人勃林格殷格翰公司发明专利权的产品。
这也就造成了利格列汀片在专利纠纷中“败诉”后大规模撤网的情况。据不完全统计,上海、广东、浙江、陕西、安徽等多地药械集中采购部门都相继发布通知,暂停东阳光药业利格列汀片挂网采购资格。
虽然东阳光的仿制药自2020年上市后就已经撼动了原研在市场上的地位,但利格列汀若与恩格列净、替格瑞洛等在专利诉讼纠纷尚未“了结”就遭遇集采的“命运”相比,已经“幸运”多了。因为除东阳光外,国内已有扬子江、石药、科伦和华海的利格列汀片仿制药过评。专利律师陈珏对此感慨:“若不是BI在专利诉讼中胜诉,利格列汀离集采也不远了。”
专利有纠纷,或再难解锁集采
随着集采走向制度化与常态化,如何保障集采产品不受专利纠纷的影响,关乎原研药企与仿制药企的切身利益。
如果说《专利法》第七十六条的专利链接制度,是把药品上市审批与相关专利争端解决程序相“链接”,那么国家知识产权局、国家医保局在2022年末联合印发的《关于加强医药集中采购领域知识产权保护的意见》(简称:《意见》),则将药品集采挂网与知识产权保护相“衔接”,进一步填补了国内药品申报集采挂网阶段产生专利纠纷时的政策空白,避免后续出现专利侵权产品挂网后撤网造成的临床使用短缺。
其实早在2019年的第二批国家集采中,就已经明确了申报企业需要就不违反《专利法》作出承诺。虽然政策文件每年都有调整,但声明不涉及专利侵权的承诺已经是国家组织集中带量采购申报过程中的固定“栏目”。江苏某仿制药企业负责人李林告诉E药经理人,以2022年7月进行的第七批国家药品集中采购为例,在集采相关文件的“全国药品集中采购申报承诺函”中,便明确要求企业作出“我方承诺申报品种不存在违反《中华人民共和国专利法》《中华人民共和国反不正当竞争法》《中华人民共和国药品管理法》等相关法律法规的情形,若产生相关纠纷,给采购方造成的损失由我方承担。”的承诺,但是“这更像一种‘宣誓’,对企业来说即使真的处在纠纷中,也不会主动撤回申报材料。”李林略显无奈。
全国政协委员、复旦大学上海医学院副院长朱同玉在今年两会中提交的提案中便提出加强集采产品的专利保护。朱同玉表示,涉专利侵权的药品一旦纳入国家集采或在地方招采平台挂网,大量生产销售,通过成本优势挤占原研药市场份额,不仅将导致专利权人不可挽回的损失,还会严重打击原研企业的研发积极性。
最典型的专利未到期已经开展集采的产品就是替格瑞洛。而信立泰与阿斯利康连续反转的专利战,也让人难忘。

注:
替格瑞洛专利诉讼时间线
替格瑞洛保护化合物结构的专利ZL99815926.3原本于2019年12月2日到期,主要保护晶型I、晶型III及晶型IV的保护晶型的专利ZL01810582.3与保护晶型II分案ZL200610002509.5则是会在2021年5月31日到期。但是在专利ZL99815926.3遭遇一波三折的专利诉讼、上诉,从专利被判无效、仿制药上市、到原研药企上诉、中间触发集采,直到最终判定仿制药侵权,这场专利纠纷历时一年多年,替格瑞洛的仿制药在专利被判无效期间陆续上市,产品也被纳入了第四批国家集中带量采购中。即使最终阿斯利康保住了替格瑞洛的专利有效,但随着化合物专利的到期、集采的落地、仿制药的上市,市场格局早已在这场纠纷中大变。
正因为药品带量采购直接影响着原研药和仿制药之间的竞争,专利问题也就成为带量采购中不能忽视的重要问题。政策研究学者牛斌认为,若中标产品涉嫌专利侵权,将会有大量的医疗机构采购并使用侵权产品,这必将侵害专利权人合法权益,还可能影响药品的医院供应与临床使用。在《关于加强医药集中采购领域知识产权保护的意见》出台后,处在专利诉讼中、或存在争议的产品,都不会出现在集采名单中。陈珏解释道,此前国家组织药品集中带量采购的公示时间普遍为30天,但是对于有专利争议的产品来说,因为专利侵权的认定具有较高的专业度与复杂性,负责药品集中带量采购的部门在收到异议,往往难以快速作出专业的评估,需要等待人民法院或知识产权管理部门作出认定后,再采取相应举措。“但这个过程往往都超过30天,仅通过这个形式阻止专利争议药品进入集采并不现实。”陈珏表示。
这一局面或将在《意见》出台后得到了改善。“随着知识产权系统与医疗保障系统开始协作,医疗部门可以请知识产权部门就相关产品专利侵权异议在规定期限内给出咨询或侵权判定意见,以此作为评价相关产品参加集采或挂网的参考。”陈珏指出,随着贯穿药品全生命周期的专利保护与侵权纠纷解决机制的不断完善,也为药品集采制度走向常态化提供更优的政策环境。

“光脚”仿制药还要不要挑战专利?
国内专利保护制度越来越完善,仿制药企还要不要发起专利挑战?
“专利保护制度不仅仅是保护原研药,同样也保护着仿制药。”西南地区某仿制药企研发负责人郑捷直言,“对于不具有创新的专利,仿制药企当然要挑战,并且还要敢于发起。”郑捷向E药经理人解释道,专利挑战并非“故意侵权”,而是挑战其专利的创新性。
《药品专利纠纷早期解决机制实施办法(试行)》(简称:《办法》)的出台便极大的保护药品专利权人合法权益,鼓励新药研究,促进高水平仿制药发展。根据该办法,申请人提交化学仿制药、中药同名同方药、生物类似药上市注册申请时,应当对照已在中国上市药品专利信息登记平台公开的相关药品专利信息,按要求提交专利声明,并将声明及声明依据通知上市许可持有人。未提交专利声明的,补正后方予以受理。而四种不同类型的声明,也反映了当前国内仿制药企在研发仿制药时的不同策略。
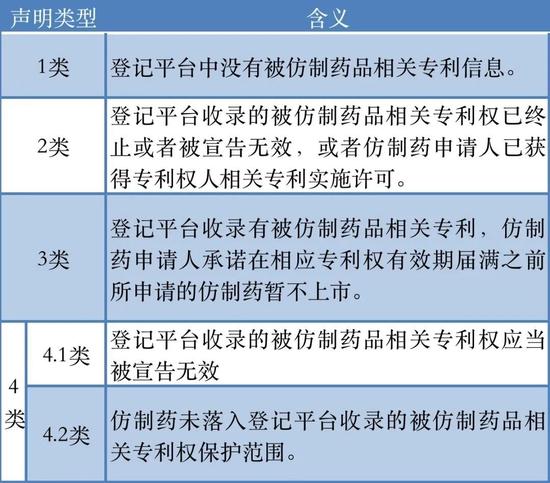
《药品专利纠纷早期解决机制实施办法(试行)》
去年4月,北京知识产权法院宣判的中外制药株式会社诉温州海鹤药业的专利纠纷案件便颇具代表性。陈珏介绍,该案中温州海鹤提交的是4.2类专利声明,主张仿制药不在原研药专利保护范围之内。而另外两家同为艾地骨化醇软胶囊的仿制药企业的声明类型与温州海鹤药业也完全不同。其中一家选择宣告登记平台中的专利无效;另一家则提交了3类专利声明,即在专利有效期内不上市仿制药。
“仿制药企业的研发策略直接反映在其专利声明中。”陈珏表示,“3类声明与4.1类声明,说明仿制药企业和原研公司采用的技术路线可能更为接近。而4.2类声明,可以理解为仿制药和原研药的技术路线有一定的差异。”对此,陈珏进一步解释道:“但这也意味着申报4.2类声明的企业,其仿制药的研发在质量与疗效的一致性评价中,将有更大的挑战,比如辅料或辅料的用量都与原研不同。反之,与原研技术路线更接近的仿制药,在一致性评价中的挑战也相对较小。”
“在首仿药12个月独占期制度出台后,仿制药企业挑战专利的热情更高了。”李林表示,尤其是对于国内的“光脚”企业来说,更是如此。“先构建起自己的技术手段与研发能力,再去挑战专利的创新性,我们没什么好怕的。”郑捷有些开玩笑的说道,“有一半的成功率,为什么不勇敢一把?挑战成功能获得市场独占期,挑战失败大不了就等专利到期再上市。”
注:文中牛斌、李林、郑捷为化名。
