武田创新酶替代疗法在美国申报上市,并获优先审评资格!
转自:医药观澜
▎药明康德内容团队编辑
5月17日,武田(Takeda)宣布,美国FDA已经接受其创新酶替代疗法TAK-755的生物制品许可申请(BLA),并授予其优先审评资格,用于治疗先天性血栓性血小板减少性紫癜(cTTP)。FDA还同时授予该产品罕见儿科疾病(RPD)认定。武田新闻稿指出,如果获批,TAK-755有望成为首个治疗cTTP的重组ADAMTS13酶替代疗法。

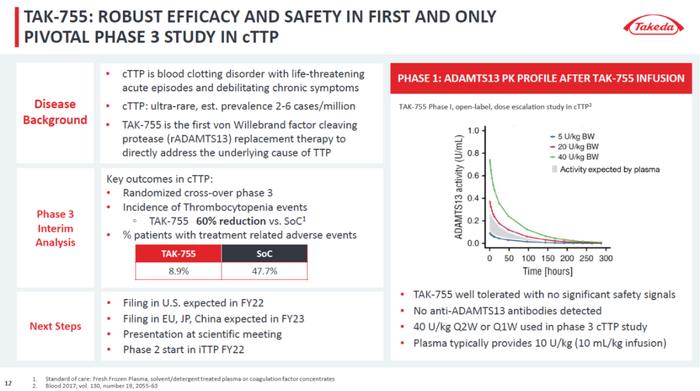
先天性血栓性血小板减少性紫癜(cTTP)是一种超罕见的慢性凝血疾病,发病原因是由于ADAMTS13酶的缺失,导致血管性血友病因子(VWF)多聚体在血液中积累。这些VWF多聚体的积累导致血小板的聚集和粘连,造成小血管中异常凝血,并出现溶血性贫血和血小板减少症。如果不及时治疗,急性TTP发作的死亡率高达90%。
公开资料显示,TAK-755是一款处于临床开发阶段的重组ADAMTS13蛋白。它通过替代缺失或功能失常的ADAMTS13酶,为TTP患者提供了一种靶向疗法。此前该产品已经获得FDA授予的快速通道资格和孤儿药资格,用于预防和治疗cTTP。
根据武田新闻稿,本次其递交TAK-755的上市申请得到了随机对照试验的疗效、药代动力学、安全性和耐受性方面的总体证据支持,并得到了一项持续研究的长期安全性和有效性数据的支持。其中,一项关键性3期试验旨在评估与基于血浆的疗法(目前的标准治疗)相比,TAK-755在多个临床相关终点上的临床获益。
武田于2023年1月公布的中期结果显示,与标准治疗相比,TAK-755将患者出现血小板降低事件的频率降低60%,血小板减少事件是cTTP疾病活动性的重要标志。此外,接受TAK-755治疗的患者中8.9%出现治疗相关不良事件,显著低于标准治疗(47.7%)。该研究第三阶段结果的中期分析将在即将召开的科学会议上公布。此外,武田还正在进行一项2b期临床研究,评估TAK-755治疗免疫介导的TTP的安全性和有效性。
武田罕见病遗传学和血液学治疗领域负责人DanielCurran博士表示:“cTTP是一种极其罕见的、危及生命的疾病,目前尚无专门批准用于预防性治疗的方法。TAK-755是临床开发中第一个提供靶向替代ADAMTS13酶的治疗药物,可解决该疾病的根本原因。我们继续受到鼓舞,并正在与FDA和其他全球监管机构密切合作,目标是将这种治疗方法带给患者。”
了解更多罕见病相关知识及研究进展
请点击访问我们的小程序
[1]U.S.Food&DrugAdministrationGrantsPriorityReviewofTAK-755fortheTreatmentofCongenitalThromboticThrombocytopenicPurpura(cTTP).RetrievedMay 17 ,2023.From https://www.takeda.com/newsroom/newsreleases/2023/us-food-drug-administration-grants-priority-review-of-tak-755
