2022 SABCS—王中华教授:ADC药物的年度关键研究进展盘点
转自:医学界
导语
新型ADC药物不断优化乳腺癌治疗格局,未来可期。
2022年圣安东尼奥乳腺癌大会(SABCS)于12月10日顺利落下帷幕,至此2022年度乳腺癌领域的重要学术会议也到此结束,每年SABCS大会以及乳腺学界都将在此时进行领域的年度进展盘点。ADC药物近年来在乳腺癌治疗领域飞速发展,引领乳腺癌进入了新的治疗时代。今年ADC药物有多项重磅研究出炉,被称为“ADCBlockbusterYear”,诸如DESTINY-Breast04(DB04)、DESTINY-Breast03(DB03)、TROPiCS-02研究等自首次公布结果以来便备受领域学者关注。在此,ADCAcademy邀请复旦大学附属肿瘤医院王中华教授,对ADC药物在2022年取得的重要研究进展进行盘点和点评。
专家简介

ASCO:DB04证实T-DXd在HER2低表达乳腺癌的疗效,开辟HER2新分型
DB04是一项全球、随机、开放性、注册III期试验,评估了T-DXd(5.4mg/kg)对比研究者选择的化疗(TPC,卡培他滨、艾立布林、吉西他滨、紫杉醇或白蛋白结合型紫杉醇)治疗既往接受过一线或二线化疗的HR阳性或HR阴性HER2低表达不可切除和/或转移性乳腺癌(MBC)患者。患者以2:1的比例随机接受T-DXd或TPC治疗。主要研究终点为HR阳性患者中盲态独立审评中心(BICR)评估的PFS,关键次要终点为总体人群中BICR评估的PFS,以及总体人群和HR阳性人群的OS[1]。

主要终点T-DXd显著延长HR阳性/HER2低表达人群的PFS:
该人群中两组的PFS分别为10.1个月vs5.4个月,疾病进展或死亡风险降低49%(HR=0.51;95%CI:0.40-0.64;p<0.001),T-DXd相比TPC组呈现出接近2倍的优势。
关键次要终点HER2低表达总体人群的PFS同样获得显著延长:
不论HR状态如何,研究入组的HER2低表达总体人群的PFS分别为9.9个月vs5.1个月,疾病进展或死亡风险降低50%(R=0.50;95%CI:0.40-0.63;p<0.001)。
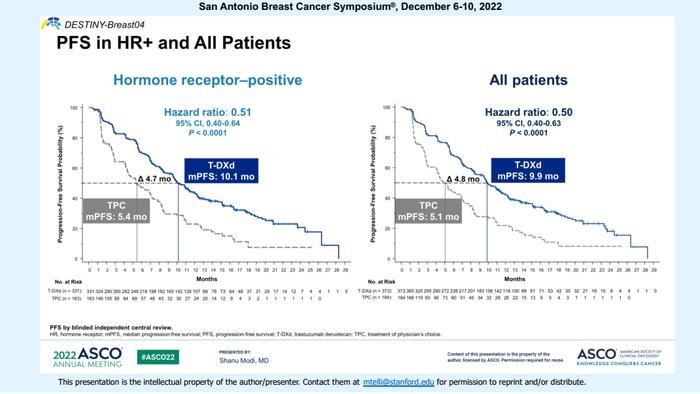
关键次要终点OS,在HR阳性/HER2低表达和总人群中均获得显著延长:
对于HR阳性患者,两组中位OS分别为23.9个月vs17.5个月,死亡风险降低36%(HR=0.64;95%CI:0.48-0.86;p=0.003);在ITT人群中,两组的中位OS则为23.4个月vs16.8个月,死亡风险降低36%(HR=0.64;95%CI:0.49-0.84;p=0.001)。
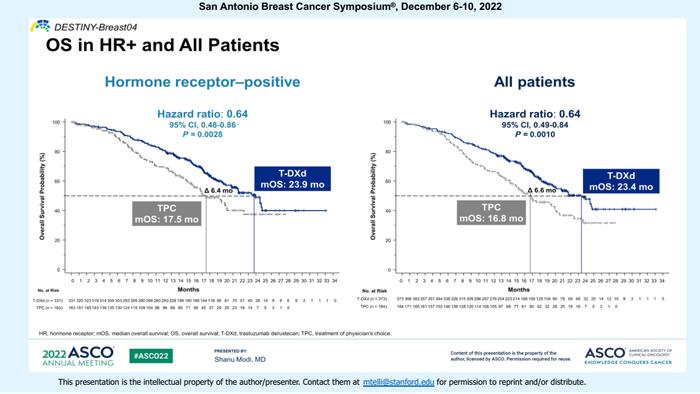
该研究也对HR阴性/HER2低表达人群进行了探索性疗效分析:
该人群被传统归类为三阴性乳腺癌,预后相比HR阳性患者更差,但研究显示T-DXd依然可以显著延长PFS和OS,两组的中位PFS:8.5个月vs2.9个月,中位OS:18.2个月vs8.3个月。
值得大家关注的是,DB04研究虽然并未针对HR阴性受试者亚组计算样本量,而是只针对四个参与α控制的指标考虑了样本量的计算。从统计学角度,HR阴性受试者是一个普通亚组,就像年龄,ECOG评分等亚组类似,不需要单独计算样本量,只需要基本符合目标人群的流行病学特征即可。2021年《NPJBreastCancer》刊登的文章显示:在HER2低表达人群中,HR阳性占比在90%左右,而三阴性人群占比10%左右[2]。DB04研究中HR阴性受试者的入组比例也符合临床实践中HER2低表达人群流行病学特征。
T-DXd在全人群中的获益并非来自于HR阳性人群的疗效驱动,而是HR阴性人群本身也可获益,且获益程度与HR阳性人群一致,因而获得FDA批准和多项权威指南的认可和推荐。
因此,无论HR状态如何,T-DXd相比TPC,都可以显著提高HER2低表达转移性乳腺癌患者的PFS和OS。
DB04研究是首个在HER2低表达乳腺癌中进行探索的III期临床试验,证实T-DXd能为HER2低表达乳腺癌患者带来前所未有的具有统计学意义和临床意义改善的PFS和OS获益,打破了既往抗HER2靶向治疗仅针对HER2阳性乳腺癌有效的传统局面。DB04研究由此改写了乳腺癌HER2状态非阳即阴的二分类模式,开启了乳腺癌HER2阳性、HER2阴性、HER2低表达三分法的新时代。
尽管HER2低表达约占全部乳腺癌的半壁江山,但由于HER2低表达乳腺癌既往缺乏针对性治疗手段往往被归类到HR+/HER2-和TNBC的范畴。其中对于HR+/HER2-晚期乳腺癌(HER2低表达患者约占55%-65%)[3]而言,一线、二线首选CDK4/6抑制剂联合内分泌治疗,而在CDK4/6抑制剂治疗进展后,尚无标准治疗推荐。并且从目前公布的研究进展来看,后续包括PI3K/AKT/mTOR抑制剂、HDAC抑制剂、CDK4/6抑制剂跨线治疗、口服SERD、化疗等治疗手段的≥2线中位PFS获益仅为2-8个月[4]。DB04研究共纳入88.7%(494/557)的HR+/HER2低表达乳腺癌患者,这部分患者群体中近70%(348/494)为CDK4/6抑制剂经治人群,2022年SABCS大会最新公布的亚组分析数据显示[5],对于CDK4/6抑制剂治疗进展后的HR+/HER2低表达患者,T-DXd和TPC组的中位PFS分别为10.0个月和5.4个月,两组的ORR分别为50.6%和13.0%,与HR阳性总体人群具有一致的获益趋势。因此从疗效数据上看,T-DXd无疑能为HR阳性/HER2低表达乳腺癌患者提供全新的更优治疗选择。
此外,对于TNBC患者(HER2低表达患者约占35%)[3]而言,一线治疗仍以化疗为主,在≥2线治疗选择方面,新型ADC药物SG治疗既往接受过2-4线化疗的转移性TNBC患者,中位PFS为5.6个月[6]。亚组分析显示,其疗效不受HER2低表达状态和治疗线数影响。针对HER2低表达转移性TNBC,其中位PFS为6.2个月,中位OS为14个月,ORR为32%;针对既往接受过2线治疗的患者,其中位PFS、中位OS、ORR则分别为5.7个月、10.9个月、30%[7]。DB04研究纳入了11.3%的HR阴性/HER2低表达乳腺癌患者,T-DXd治疗既往接受过1-2线化疗的HR阴性/HER2低表达乳腺癌患者,中位PFS为8.5个月,中位OS达到18.2个月,并且获得较深的疾病缓解,ORR达到50%。相比其他晚期TNBC≥2线研究的治疗获益,T-DXd在数值上同样呈现一定优势,可作为一线治疗进展后HR阴性/HER2低表达乳腺癌患者的重要选择。
总体而言,得益于DB04研究的突破性成果,T-DXd在HER2低表达乳腺癌中的治疗价值毋庸置疑。并且基于该研究,2022年8月,FDA已经批准T-DXd治疗HER2低表达乳腺癌的适应症。同样在2022年8月,CDE已经正式承办HER2低表达适应症的上市申请,该适应症或将在2023年8月获批。这也是T-DXd短短半年间在国内的第二个上市申请,同时也是中国首个针对HER2低表达转移性乳腺癌适应症的上市申请。期待未来随着T-DXd在国内获批上市,将会有更多患者从T-DXd的治疗中获益。
ASCO:TROPiCS-02拓展TROP-2ADC治疗人群,为HR阳性/HER2阴性乳腺癌提供选择
TROPiCS-02是一项全球性、多中心、开放标签的临床III期试验,共纳入543例HR阳性/HER2阴性转移性乳腺癌患者,按照1:1的比例随机分配至SG组或TPC组(卡培他滨、艾立布林、吉西他滨或长春瑞滨)。入组患者既往曾接受过至少1种内分泌药物和1种CDK4/6抑制剂、1种紫杉类药物的治疗,并在转移性阶段接受过2-4线化疗。主要终点为BICR评估的PFS,次要终点包括OS,LIR和BICR评估的ORR、DOR、CBR等。

2022年ASCO大会公布的数据显示[8],在ITT人群中,SG组的中位PFS为5.5个月,显著优于TPC组的4.0个月,但是OS没有统计学差异。2022年ESMO大会则公布了该研究第二次期中分析的OS数据[9],两组的中位OS分别为14.4个月和11.2个月,SG组首次表现出具有统计学意义的治疗优势。
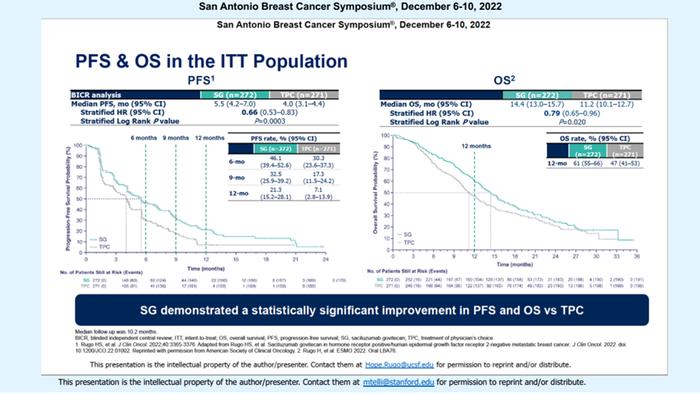
TROPiCS-02研究是首个在HR阳性/HER2阴性转移性乳腺癌后线治疗中获得阳性结果的III期临床研究,入组人群为100%CDK4/6抑制剂经治患者,符合当前的临床治疗实践,结果证实SG相比化疗具有显著的PFS和OS获益,为SG作为HR阳性/HER2阴性晚期乳腺癌后线治疗选择提供了坚实的循证证据,并且也进一步拓展了TROP-2靶向ADC药物的适用人群。
HR阳性/HER2阴性乳腺癌中,HER2低表达患者约占55%-65%。DB04研究表明,T-DXd治疗HR阳性/HER2低表达晚期乳腺癌患者,其中位PFS为10.1个月,中位OS为23.9个月,且CDK4/6抑制剂经治亚组患者具有一致的获益趋势。横向对比目前在HR+/HER2-晚期乳腺癌≥2线治疗领域进行的研究,T-DXd的生存获益在数值上更优,相比SG同样如此。基于DB04研究成果,其低表达适应症已得到获批,且国内上市指日可待。并且NCCN、ASCO、CBCS指南先后推荐T-DXd作为HER2低表达乳腺癌(HR阳性患者必须为内分泌难治)的治疗推荐。
基于现有数据和指南推荐,对于HR阳性/HER2低表达乳腺癌患者,T-DXd是首选,但其治疗进展后能否序贯SG,有待进一步评估。从结构和机制特点上看,SG和T-DXd均为新型ADC药物,并且都能够发挥强大的旁观者效应,并具有较高的药物抗体比(DAR),但T-DXd的载药活性是SG载药活性的10倍[10],这可能部分解释了其疗效存在差异的原因,而将好药用于前线也符合当前的临床治疗思路。然而,由于T-DXd和SG的载药均为拓扑异构酶I抑制剂,因此两者有交叉耐药的风险,但由于治疗靶点不同则可能形成非载药相关的耐药机制,这需要临床研究证实两者是否可以序贯使用。
SABCS:DB03研究数据更新,PFS达到28.8个月,OS延长达到统计学显著差异
DB03是一项随机、开放标签、多中心III期临床研究,是首个ADC药物之间头对头比较的临床试验,研究共入组524例患者,按照1:1随机分配至T-DXd组和T-DM1组。主要研究终点为BICR评估的PFS,关键次要研究终点为OS,其他次要研究终点包括ORR(BICR和研究者评估)、DoR和安全性等。2021年ESMO大会首次公布研究成果显示[11],数据截止2021年5月20日,T-DXd和T-DM1组的中位随访时间分别为16.2个月和15.3个月,BICR评估的中位PFS,T-DXd组相比T-DM1组的P值低至10-22,疾病进展或死亡风险下降达到前所未有的72%(HR=0.28)。相比对照组OS数据尚未成熟,但已呈现显著获益趋势。

2022年SABCS大会公布了更长随访时间的更新数据(T-DXd组为28.4个月,T-DM1组为26.5个月)[12],两组的OS均未达到(NRvsNR,HR=0.64,95%CI,0.47-0.87,P=0.0037),但是OS的P值已超过预设边界 (P=0.013),具有统计学意义,疾病死亡风险降低36%。
12个月的OS率两组分别为94.1%vs86.0%,24个月的OS率两组分别为77.4%vs69.9%,T-DXd组的绝对治疗获益接近8%,并且从OS曲线可以看出,后续两组的差异可能会随着随访时间的延长而愈加明显。
进展后的治疗方案选择,T-DXd组中64/182(35.2%)的患者接受了T-DM1治疗,T-DM1组中42/243(17.3%)的患者接受了T-DXd治疗。尽管两组允许交叉治疗,但是最终T-DXd组仍有显著OS获益,体现了T-DXd强大的二线治疗效果。
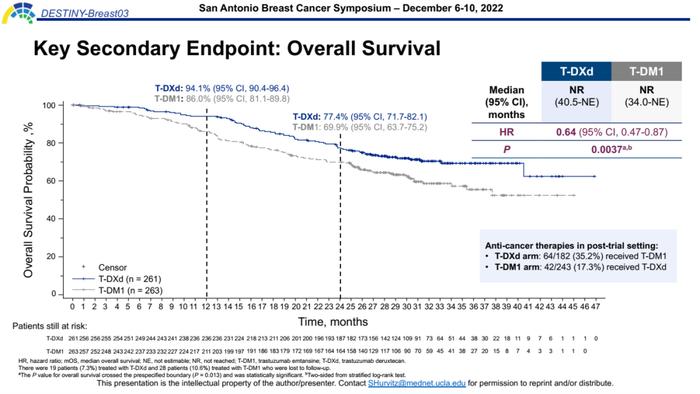
此外,包括不同HR状态、是否帕妥珠单抗经治、是否基线伴有内脏转移、既往治疗线数如何以及是否基线伴有脑转移的各亚组中,均观察到T-DXd相比T-DM1具有显著OS获益,与总人群趋势一致。
更新的BICR评估的PFS,T-DXd组长达28.8个月,是T-DM1组6.8个月的4.2倍(HR=0.33,95%CI,0.26-0.43,P<0.000001),疾病进展和死亡风险降低67%,相比既往数据进一步延长,再次将HER2阳性晚期乳腺癌二线治疗获益提升到新的高度,进一步彰显其二线治疗卓越实力。两组12个月的PFS率分别为75.2%vs33.9%,24个月的PFS率分别为53.7%vs26.4%,T-DXd组的PFS绝对获益十分显著。
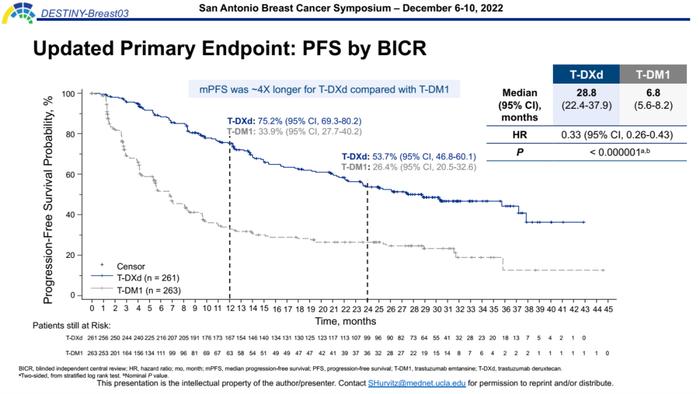
确认的ORR(BICR评估)和其他疗效终点方面,T-DXd组呈现深度疾病缓解,其ORR达到78.5%,高于T-DM1组的2倍之多(P<0.0001)。并且T-DXd组的完全缓解(CR)率高达21.1%,如此高的CR率在既往抗HER2治疗研究中可谓是全新的突破,这意味着超过1/5的患者接受T-DXd治疗后达到影像学无病灶证据(NED),有望实现肿瘤长期不复发这种类似治愈的状态。此外,T-DXd组的CBR达到89.3%,BICR评估的中位DOR长达36.6个月,均相比T-DM1组具有明显优势。
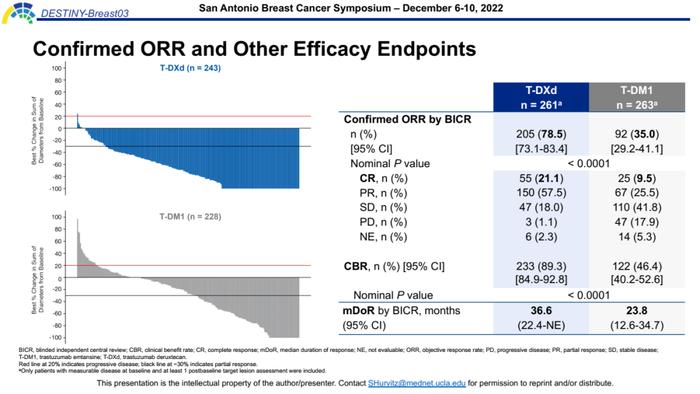
本次数据更新还公布了研究者评估的PFS2结果,T-DXd组长达40.5个月,T-DM1组为25.7个月,两组分别有71.4%和78.6%的患者接受后续治疗,尽管T-DXd组中大多数患者在后续接受了疗效相对较差的其他药物治疗,但其在前线治疗的获益可以一直延续到后线,即便在试验方案治疗发生进展后,T-DXd相比T-DM1组仍显示出PFS获益优势。这也提示T-DXd前线治疗并不会对后续治疗药物的疗效产生影响,进一步支持其二线治疗优选地位。
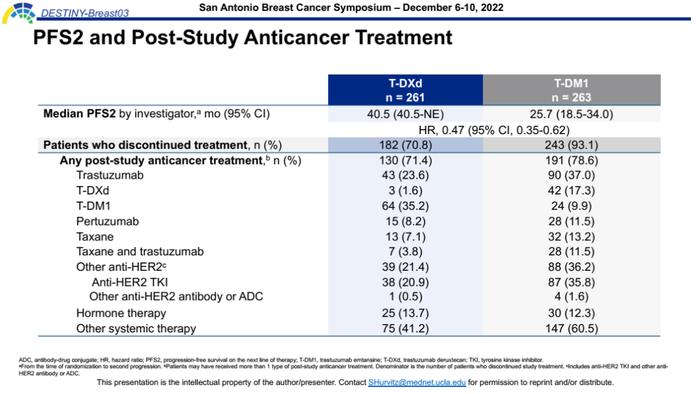
安全性方面,任何级别ILD的发生率为15.2%,多数为1、2级,尽管相比既往报道(2021ESMO:10.5%)有所增加,但≥3级ILD依旧仅为0.8%,仍然没有发生4、5级ILD。这也提示随着随访时间的延长,T-DXd仍具有较高的获益/风险比,并不会因为ILD的发生而影响疗效。
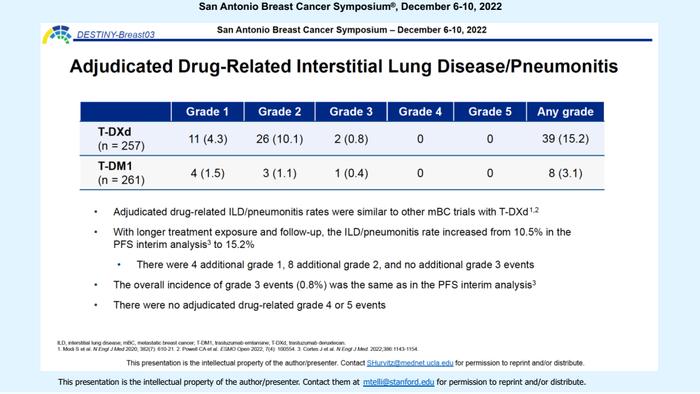
DB03自研究设计公布之初便备受关注,因为这不仅仅是两个ADC药物之间的首次头对头对比,更是可能颠覆既往二线标准,重塑乳腺癌治疗格局的重大转折。从2021年ESMO大会作为头号LBA公布研究成果,就能看出该研究的重磅性不同一般,数据一经披露便引起巨大轰动。T-DXd二线治疗HER2阳性晚期乳腺癌相比T-DM1取得了压倒性的绝对获益优势,中位PFS获益首次突破两年,包括ESMO、ABC6、NCCN、ASCO权威指南相继更新,共同推荐T-DXd作为HER2阳性晚期乳腺癌二线优选方案。2022年5月T-DXd二线治疗适应症已经获得FDA批准。并且国内CSCO、CBCS指南也紧跟国际脚步,将T-DXd纳入HER2阳性晚期乳腺癌的二线治疗推荐。尽管由于国内外药物可及性存在差异,目前国内对T-DXd的推荐等级偏低,但是令人欣慰的是,在2022年4月,T-DXd晚期二线治疗适应症已经获得CDE优先审评资格,并且大概率会在2023年3月份获批上市,届时随着T-DXd用药可及性的提高,国内学者对HER2阳性晚期乳腺癌的治疗排兵布阵又将迎来新一轮的变革。
2022年SABCS大会更新了DB03研究的OS中期分析数据,结果同步发表于《柳叶刀》(TheLancet),这也是既2022年3月PFS中期分析结果登顶《新英格兰医学杂志》(NEJM)之后,DB03研究在短短的9个月内第二次亮相于国际顶级期刊。本次发表的结果同样不负众望,主要终点BICR评估的中位PFS长达28.8个月,再次突破HER2阳性晚期乳腺癌PFS获益天花板,并且OS首次达到统计学显著差异,实现了T-DXd相比T-DM1二线治疗的PFS和OS双重获益。值得一提的是,无论患者是否为帕妥珠单抗经治、HR状态如何、是否脑转移、是否内脏经治等,T-DXd组都能观察到显著的PFS和OS获益,成为针对HER2阳性晚期乳腺癌二线治疗全人群的优选药物,而且T-DXd也是迄今为止唯一在HER2阳性晚期乳腺癌二线治疗中,获得针对帕妥珠单抗经治患者突破性疗效数据的治疗药物。另外,高达21.1%的CR率,相比既往公布的16.1%进一步提高,让目前仍被认为无法治愈的晚期乳腺癌患者获得长期肿瘤不复发成为可能,真正为患者维持疾病深度缓解的长期生存状态创造了条件。
此外,在临床上较为关注的ILD发生率方面,T-DXd的表现令人欣慰,尽管随访时间(从16.2个月到28.4个月)和T-DXd的用药时间(从14.3个月到18.2个月)均有所延长,但仍然只有2例患者(0.8%)发生≥3级ILD,并且4、5级ILD并未发生,提示ILD可耐受、可控制,并不影响患者的长期生存获益。这可能与临床上对于ILD认识的逐渐深入,以及管理措施日益完善有关。当然为了进一步保证患者治疗获益的持续性,对于ILD仍需要严密监测。
总的来说,横向对比既往一系列抗HER2治疗研究,T-DXd展现出的惊艳疗效可谓史无前例。作为新型抗肿瘤药物的佼佼者,更作为新一代ADC的标杆药物,T-DXd将抗HER2治疗获益提升到了一个全新的高度,可能很长一段时间内,都很难有药物超越。并且未来也会有一系列研究围绕T-DXd展开。总之,以T-DXd为分水岭,追求更高生存获益的抗HER2治疗新时代已然来临。
展望未来:新次序,新格局,开启乳腺癌治疗优化之路
2022年ADC药物在乳腺癌治疗领域无疑取得了重大突破,并随着相关研究结果的披露,不断影响着乳腺癌治疗格局:DB03树立了HER2阳性晚期乳腺癌的二线治疗新标准,首当其冲成为该领域最为重磅的研究成果;DB04正式确立了HER2低表达成为新的靶向治疗亚型,其成果的发布具有里程碑意义,为HR阳性/HER2低表达、HR阴性/HER2低表达人群提供精准治疗获益的机会;TROPiCS-02为CDK4/6抑制剂经治HR阳性/HER2阴性晚期乳腺癌患者带来了全新治疗选择,并拓展了TROP-2靶向ADC适用人群。
在HER2阳性晚期乳腺癌治疗领域,基于DB03研究的突破性成果,T-DXd已经稳居二线标准治疗方案的宝座,标准一线治疗选择仍是THP,T-DM1则退居三线,≥4线治疗选择包括化疗+Margetuximab、化疗+曲妥珠单抗、卡培他滨+奈拉替尼/拉帕替尼等。
在TNBC治疗领域,晚期一线治疗以化疗±帕博利珠单抗为主,对于gBRCA1/2突变的患者则优先选择PARP抑制剂。二线及以后的治疗选择包括SG、PARP抑制剂(gBRCA1/2突变)、T-DXd(HER2低表达)、化疗。在用药次序中,SG序贯T-DXd治疗模式的有效性值得思考。
在内分泌难治的HR阳性/HER2阴性乳腺癌治疗领域,一线选择化疗,对于gBRCA1/2突变的患者优先选择PARP抑制剂。二线治疗包括T-DXd(HER2低表达)、PARP抑制剂(gBRCA1/2突变)、化疗。三线及以后的治疗选择包括化疗、PARP抑制剂(gBRCA1/2突变)或者SG。在用药次序中,T-DXd序贯SG治疗模式有待进一步研究确证。
此外,新型ADC药物还在不断探索之中,以期进一步拓展治疗获益人群。T-DXd将战线前移,有望通过DB09成功挑战THP标准一线治疗地位,再度掀起HER2阳性晚期乳腺癌的治疗新浪潮;同时,DB11、DB05分别布局HER2阳性早期乳腺癌新辅助和辅助治疗领域,或将进一步丰富HER2阳性早期乳腺癌治疗策略;DB06评估了T-DXd在HER2超低表达人群的治疗获益,研究结果将为进一步明确HER2低表达下限值提供重要理论依据。另外,SG、Dato-DXd这类TROP-2靶向ADC药物在TNBC晚期一线和早期治疗领域也都进行了积极探索。相信未来随着更多研究数据的公布,乳腺癌治疗将迎来百花齐放、满园春色的大好局面。
参考文献:
[1]ModiS,JacotW,YamashitaT,etal.DESTINY-Breast04TrialInvestigators.TrastuzumabDeruxtecaninPreviouslyTreatedHER2-LowAdvancedBreastCancer.NEnglJMed.2022Jul7;387(1):9-20.
[2]SchettiniF,ChicN,Brasó-MaristanyF,etal.Clinical,pathological,andPAM50geneexpressionfeaturesofHER2-lowbreastcancer.NPJBreastCancer.2021Jan4;7(1):1.
[3]《人表皮生长因子受体2低表达乳腺癌临床诊疗共识(2022版)》
[4]HuangJ,ZhengL,SunZ,LiJ.CDK4/6inhibitorresistancemechanismsandtreatmentstrategies(Review).IntJMolMed.2022Oct;50(4):128.
[5]HarbeckN,ModiS,JacotW,etal.TrastuzumabDeruxtecanvsTreatmentofPhysician'sChoiceinPatientsWithHER2-LowUnresectableand/orMetastaticBreastCancer:SubgroupAnalvsesFromDESTINY-Breast04.2022SABCS.P1-11-01.
[6]BardiaA,TolaneySM,LoiratD,etal.SacituzumabGovitecanVersusTreatmentofPhysician'sChoiceinPatientsWithPreviouslyTreatedMetastaticTriple-NegativeBreastCancer:FinalDataFromthePhase3ASCENTStudy.2022ASCO.1071.
[7]HurvitzSA,BardiaA,PunieK,etal.SacituzumabGovitecanEfficacyinPatientswithMetastaticTriple-NegativeBreastCancerbyHER2ImmunohistochemistryStatus:FindingsfromthePhase3ASCENTStudy.2022ESMOBC.168P.
[8]RugoHS,BardiaA,MarméF,etal.PrimaryresultsfromTROPiCS-02:Arandomizedphase3studyofsacituzumabgovitecan(SG)versustreatmentofphysician’schoice(TPC)inpatients(Pts)withhormonereceptor–positive/HER2-negative(HR+/HER2-)advancedbreastcancer.presentedat2022ASCO.LBA1001.
[9]RugoHS,BardiaA,MarméF,etal.Overallsurvival(OS)resultsfromthephaseIIITROPiCS-02studyofsacituzumabgovitecan(SG)vstreatmentofphysician'schoice(TPC)inpatients(pts)withHR+/HER2-metastaticbreastcancer(mBC).presentedat2022ESMO.LBA76.
[10]NakadaT,SugiharaK,JikohT,AbeY,AgatsumaT.TheLatestResearchandDevelopmentintotheAntibody-DrugConjugate,[fam-]TrastuzumabDeruxtecan(DS-8201a),forHER2CancerTherapy.ChemPharmBull(Tokyo).2019;67(3):173-185.
[11]CortésJ,ImS,IwataH,etal.Subgroupanalysisbydiseasehistoryandpriortreatmentsofpatients(pts)withHER2-positive(HER2+)metastaticbreastcancer(MBC)fromDESTINY-Breast03,arandomizedphaseIIIstudyoftrastuzumabderuxtecan(T-DXd)vstrastuzumabemtansine(T-DM1).2021ESMO.Abstract236p.
[12]HurvitzSA,HeggR,ChungWP,etal.TrastuzumabderuxtecanversustrastuzumabemtansineinpatientswithHER2-positivemetastaticbreastcancer:Updatedresultsoftherandomized,phase3studyDESTINY-Breast03.2022SABCS.GS2-02.
