【深度】维昇药业IPO:核心产品潜在竞争激烈,行业扩张疲态渐显
来源:财中社
9月26日,维昇药业更新了申请版本全文档案。目前,公司仍处于亏损状态。
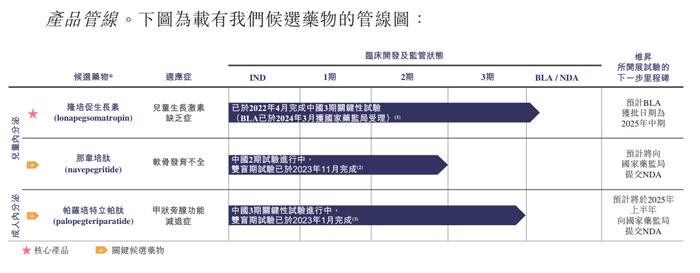
维昇药业于2018年成立,是一家处于研发后期、产品接近商业化的生物制药公司。公司核心在研产品包括隆培促生长素、那韦培肽、帕罗培特立帕肽三款。其中,隆培促生长素用于治疗3-17岁儿童生长激素缺乏症患者,那韦培肽用于治疗2-10岁软骨发育不全儿童患者,帕罗培特立帕肽用于治疗成人甲状旁腺功能减退症。
目前,隆培促生长素已在中国完成3期关键性试验,2024年3月7日该产品的BLA申报已获受理;那韦培肽已完成2期临床试验的双盲期试验,帕罗培特立帕肽正处于3期关键性试验阶段。
《财中社》发现,维昇药业三款候选药物均为从控股股东处授权引入,实际上可被视为三款药物中国地区的商业化平台。公司持续亏损,并非完全因为每年高额的研发支出,股份支付及终止合同亏损也有拖累。此外,维昇药业商业化进展最快的长效生长激素药物面临潜在竞争激烈、市场扩张难等困境,其他两种药物也是前景不明。
亏损真相:高额的股份支付及终止合同亏损
维昇药业三款候选药物均为公司成立之时自其合作伙伴及控股股东之一AscendisPharma处授权引入,公司获授予在中国开发、生产和商业化的独家许可。维昇药业目前并不拥有所有有关知识产权,且一直以来向AscendisPharma采购研发咨询服务,可见维昇药业实质上可被视作AscendisPharma三款药物中国地区的商业化平台。AscendisPharma隶属于纳斯达克上市公司AscendisPharmaA/S(ASND),AscendisPharmaA/S则是一家总部位于丹麦的生物制药公司。
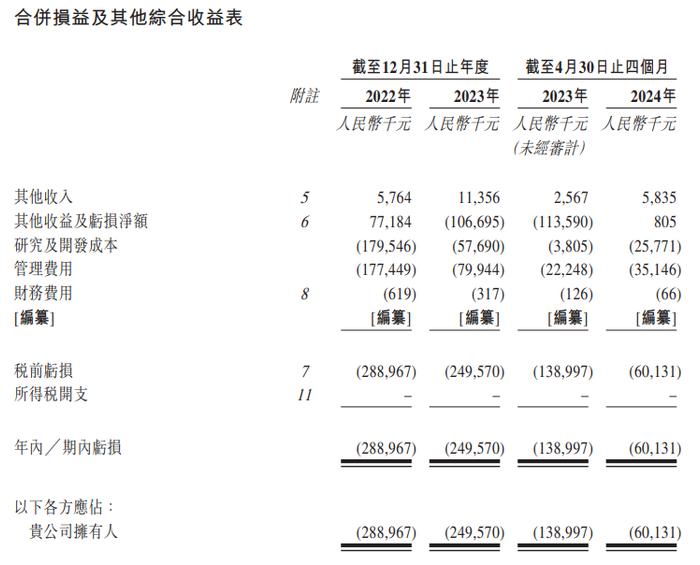
由于产品尚未实现商业化,维昇药业暂未获得产品销售收入。2022-2023年和2024年1-4月,维昇药业分别录得净亏损2.89亿元、2.5亿元和6013万元,绝大部分经营亏损是由研发开支、管理费用以及其他收益及亏损净额所致。
实际上,维昇药业每年研发投入并不算多,亏损原因其实还包括公司进行了股权激励和终止采购合同的亏损。2022年,公司以股份为基础的付款开支为9351万元,2024年1-4月为2167万元;2023年,公司产生了1.07亿元的终止采购合同的亏损。
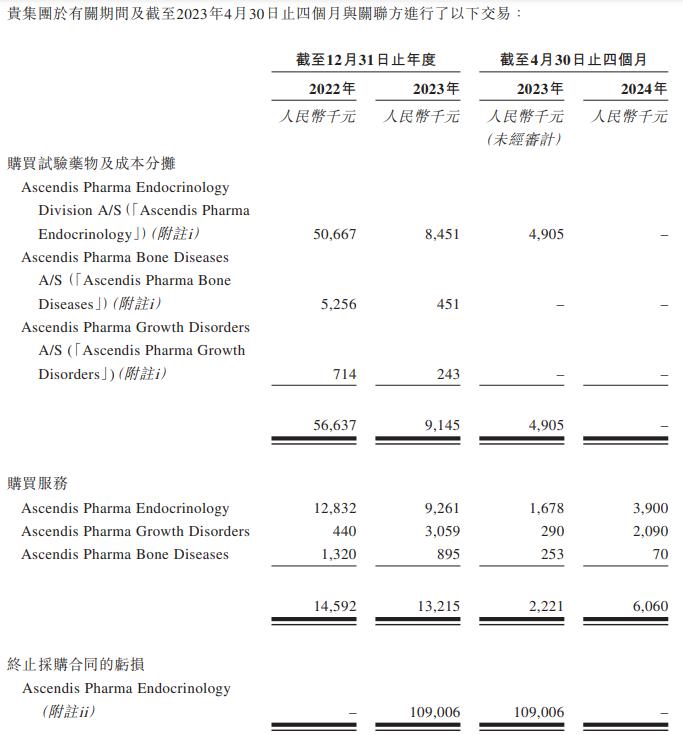
由于极度依赖AscendisPharma的技术,维昇药业每年与之发生较大金额的关联交易。2022年8月,维昇药业与之订立承诺及预付款项协议以采购储备药物原液。2023年2月,公司因其商业化供应策略发生变化,取消其根据协议采购储备药物原液的承诺,取消造成的亏损总额为1554万欧元(约合人民币1.09亿元)。
潜在竞争激烈,前景不明朗
根据申请版本全文档案,维昇药业的估值于A轮融资时为4000万美元,至B轮融资达到1.5亿美元,期间估值显著上升,主要是由于公司在核心产品隆培促生长素方面,及在另一款关键候选药物那韦培肽方面取得的研发及监管里程碑。
在海外市场,AscendisPharma的三款候选药物中,隆培促生长素已于2021年获得FDA的上市批准,并于美国商业化上市;隆培促生长素亦于2022年获得EMA的上市批准,并正在日本进行临床开发。帕罗培特立帕肽亦已分别于2023年11月及2024年8月获得EMA及FDA批准用于治疗患有慢性甲状旁腺功能减退症的成人患者,并于2024年1月在若干欧洲国家商业化上市。
根据AscendisPharma的年报,自AscendisPharma于2021年第四季度将隆培促生长素商业化上市以来,于2021年、2022年及2023年,AscendisPharma已分别录得隆培促生长素销售收入90万欧元、3570万欧元及1.79亿欧元,增长较快。
在国内市场,目前已经上市的长效生长激素只有长春高新旗下金赛药业一家,其他公司包括维昇药业在内,还有特宝生物、诺和诺德、安科生物、Genexin/天境生物、优诺金、千红制药、亿帆药业、科兴等公司有产品在研,潜在竞争激烈。
国内生长激素市场以金赛药业占据主导,一直以来长效生长激素独占市场的地位给金赛药业带来持续高增的业绩,但近期金赛药业增长已经放缓,市场扩张疲态渐显。2021-2023年,金赛药业营业收入分别为81.98亿元、102.17亿元、110.84亿元,同比增速为41.27%、24.63%、8.49%;净利润为36.84亿元、42.17亿元、45.14亿元,同比增速为33.48%、14.47%、7.04%,增速逐年下滑。
社会上一直以来都存在对生长激素滥用的质疑。据法制日报报道,目前生长激素有被滥用的苗头,可能会给使用者带来一系列健康风险,因此市场亟待规范。
对于那韦培肽和帕罗培特立帕肽,维昇药业称,国际软骨发育不全共识声明小组指出,对患有软骨发育不全的儿童进行生长激素治疗的效果一直存在争议,并且其长期效果尚不清楚;中国尚无获批准用于治疗甲状旁腺功能减退症的甲状旁腺激素替代疗法,帕罗培特立帕肽是唯一一款在研产品,到目前为止,每日一次Natpara(甲状旁腺激素(1-84))是唯一一款同时获得美国及欧盟批准的甲状旁腺激素疗法,Natpara分别于2015年和2017年获得FDA的上市批准和EMA的有条件上市许可,但随后于2019年从美国市场召回。于2022年10月,据宣布,Natpara将于2024年底在全球范围内停止生产。维昇药业能否填补市场空白,尚需产品疗效检验。
如果您有新闻线索,请联系我们:newsroom@caizhongshe.cn
特别声明:以上内容仅代表作者本人的观点或立场,不代表新浪财经头条的观点或立场。如因作品内容、版权或其他问题需要与新浪财经头条联系的,请于上述内容发布后的30天内进行。
