优赫得2期研究显示:对多种HER2表达晚期实体瘤有临床意义的生存获益 | 新闻稿
转自:研发客
☆ 第一三共和阿斯利康联合开发的德曲妥珠单抗在总研究人群中的中位无进展生存期为6.9个月,中位总生存期为13.4个月。
☆ 研究结果强调了德曲妥珠单抗作为一种不受限于肿瘤类型治疗经治的HER2表达实体瘤患者的潜力,并支持目前与全球卫生管理部门进行的讨论。
东京和新泽西州巴斯金里奇 ——正在进行的2期临床研究DESTINY-PanTumor02的阳性结果表明,注射用德曲妥珠单抗(商品名:优赫得®;后称“德曲妥珠单抗“)用于既往接受过治疗的多种HER2表达的晚期实体瘤患者中具有临床意义的持久疗效。
包括首次报告的无进展生存期(PFS)和总生存期(OS)数据在欧洲肿瘤内科学会2023年大会(ESMO23)在以重磅小型口头报告(LBA34)形式公布,并同时发表在《临床肿瘤学杂志》上。
德曲妥珠单抗是一款由第一三共和阿斯利康共同开发和商业化,基于第一三共独有技术设计的靶向HER2的抗体偶联药物(ADC)。
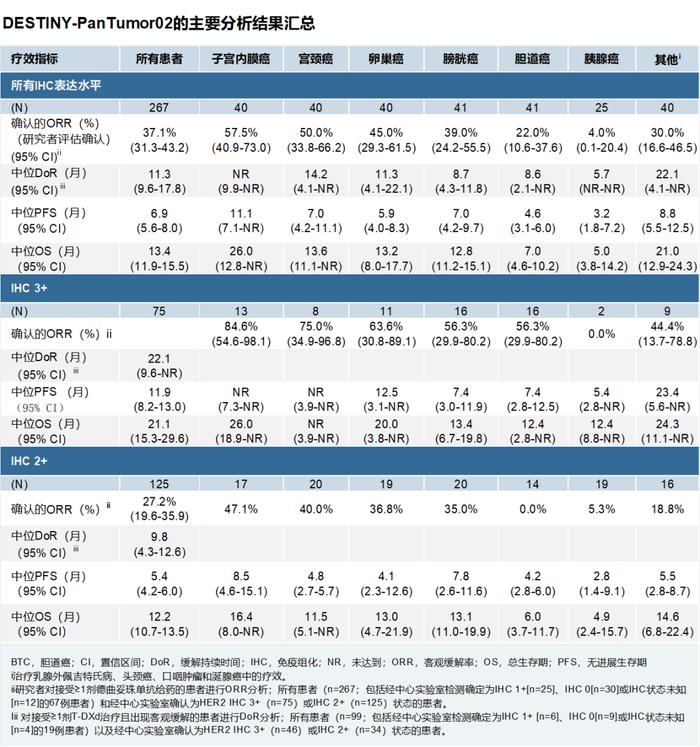
此次主要分析显示,德曲妥珠单抗在既往接受过治疗的HER2表达的晚期实体瘤(包括胆道癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌或其他肿瘤)患者(n=267)总研究人群中经研究者评估的确认的客观缓解率为37.1%(95%[CI]:31.3-43.2)。中位缓解持续时间(DoR)为11.3个月(95%CI:9.6-17.8),中位PFS为6.9个月(95%CI:5.6-8.0),中位OS为13.4个月(95%CI:11.9-15.5)。截至2023年06月08日数据截止日期时,中位随访时间为12.75个月。
经中心实验室检测确认肿瘤HER2表达即免疫组化(IHC)3+(n=75)的患者中的探索性分析显示出最高的缓解率,其中德曲妥珠单抗组确认的ORR为61.3%(95%CI:49.4-72.4)。在这一患者人群中,中位DoR为22.1个月(95%CI:9.6-NR);在IHC3+表达的患者中,德曲妥珠单抗组的中位PFS为11.9个月(95%CI:8.2-13.0),中位OS为21.1个月(95%CI:15.3-29.6)。这些具有临床意义的结果进一步肯定了今年早些时候在2023年美国临床肿瘤学会(ASCO)年会上公布的DESTINY-PanTumor02期中分析结果。
德克萨斯大学MD安德森癌症中心研究癌症治疗系主任兼研究的主要研究者FundaMeric-Bernstam医学博士说:“这些主要分析结果再次验证了II期临床研究DESTINY-PanTumor02的期中分析中所示的疗效,德曲妥珠单抗在广泛HER2表达的实体瘤中具有临床意义生存获益。基于这些研究结果,德曲妥珠单抗或将为那些治疗方案有限、目前尚无获批靶向HER2疗法的HER2表达的晚期疾病改善疾病进程、提供疾病控制疾。”
”
DESTINY-PanTumor02研究中德曲妥珠单抗的安全性特征与之前的临床研究保持一致,没有发现新的安全性问题。治疗中出现的3级或3级以上不良事件(TEAE)发生率为40.8%。最常见3级或3级以上TEAE(≥5%患者中发生)包括中性粒细胞减少症(19.1%)、贫血(10.9%)、疲乏(7.1%)和血小板减少症(5.6%)。在DESTINY-PanTumor02中,10.5%的患者(n=28)经独立裁定委员会确定为与治疗相关的间质性肺疾病(ILD)或非感染性肺炎。大多数ILD或非感染性肺炎事件级别较低(1级[n=7;2.6%]或2级[n=17;6.4%]),观察到1例(0.4%)3级事件、无4级事件(0%)和3例(1.1%)5级事件。
第一三共全球肿瘤开发部负责人MarkRutstein医学博士说:“延长患者的生存期是癌症治疗的首要目标之一,DESTINY-PanTumor02研究中观察到具有临床意义的无进展生存期和总生存期结果令人鼓舞。这些结果为德曲妥珠单抗提供了更多证据,使其有望成为首个获批用于治疗广泛瘤种HER2表达的抗体偶联药物。”
阿斯利康首席医学事务官兼肿瘤学首席开发官CristianMassacesi医学博士说:“DESTINY-PanTumor02的这些最新数据进一步表明,HER2在广泛实体瘤作为一种可作用的生物标记物的重要性。德曲妥珠单抗有潜力改善既往接受过治疗的HER2表达的肿瘤特定患者的预后。我们期望尽快将这一重要药物提供给患者。”
”
在DESTINY-PanTumor02中,40.8%的患者(n=109)既往接受过的治疗线数为3线或3线以上。截至2023年06月08日数据截止日期时,267例患者已接受治疗,其中75(28.1%)例患者经中心实验室检测确定为IHC3+。
(点开看大图)
DESTINY-PanTumor02是一项全球性、多中心、多队列、开放标签的2期临床研究,旨在评价德曲妥珠单抗(5.4mg/kg)治疗既往接受过治疗的表达HER2的肿瘤的疗效和安全性,包括胆道癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌或其他肿瘤。DESTINY-PanTumor02的主要疗效终点是由研究者评估确认的ORR。次要终点包括DoR、DCR、PFS、OS、安全性、耐受性和药代动力学。DESTINY-PanTumor02在亚洲、欧洲和北美洲的多家研究中心入组267例患者。欲了解有关该研究的更多信息,请访问ClinicalTrials.gov。
关于实体瘤中的HER2表达
HER2是一种酪氨酸激酶受体促生长蛋白,在全身多种组织细胞表面表达,参与正常细胞生长1,2。在一些癌症中,HER2表达有所增加或细胞存在激活突变1,3。HER2蛋白过表达可能是HER2基因扩增的结果,并且通常与侵袭性疾病和预后不良有关4。
虽然靶向HER2的治疗已用于治疗乳腺癌、胃癌、肺癌和结肠直肠癌,但还需进行更多的研究,以评价其治疗表达HER2的其他类型实体瘤的潜力2,5,6。
HER2是胆道癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌和胰腺癌等实体瘤的一种新兴生物标志物3。由于未对这些额外的肿瘤类型进行常规检测,因此现有的文献资料有限。在这些实体瘤中观察到的HER2过表达(IHC3+)的比例为1%至28%7,8。
对于某些表达HER2的实体瘤,特别是那些已经进展或标准疗法难治性实体瘤,目前尚无批准用于治疗这些癌症的靶向HER2的疗法,因此对有效治疗的需求尚未得到满足2,9。
关于德曲妥珠单抗
注射用德曲妥珠单抗(商品名:优赫得®;在美国称为fam-trastuzumabderuxtecan-nxki)是一款靶向HER2的抗体偶联药物(ADC)。德曲妥珠单抗采用第一三共独有的DXd-ADC技术设计,是第一三共肿瘤产品组合中的领先ADC产品,也是阿斯利康ADC科学平台中最先进的项目。优赫得®由一种HER2单克隆抗体通过可裂解四肽连接子与若干拓扑异构酶I抑制剂有效载荷(依喜替康衍生物,DXd)连接组成。
基于研究DESTINY-Breast03获得的结果,德曲妥珠单抗(5.4mg/kg)已在全球超过55个国家/地区获得批准,用于治疗既往在转移阶段或在新辅助或辅助治疗期间接受过(一种或多种)抗HER2治疗方案,且在治疗期间或完成治疗之后6个月内出现疾病复发的不可切除或转移性HER2阳性乳腺癌成人患者。
基于研究DESTINY-Breast04获得的结果,德曲妥珠单抗(5.4mg/kg)已在全球超过40个国家/地区获得批准,用于治疗既往在转移阶段接受过一种全身治疗,或在辅助化疗期间或完成辅助化疗之后6个月内出现疾病复发的不可切除或转移性HER2低表达(免疫组化[IHC]1+或IHC2+/原位杂交[ISH]-)乳腺癌成人患者。
基于研究DESTINY-Lung02获得的结果,德曲妥珠单抗(5.4mg/kg)已在全球30个国家获得批准,用于治疗通过当地或地区批准的检测方法检出肿瘤存在HER2(ERBB2)激活突变,并且既往接受过一种全身治疗的不可切除或转移性NSCLC成人患者。在确证性研究中的临床获益得到验证和确定后,将支持本适应症在美国的完全批准。
基于研究DESTINY-Gastric01和/或研究DESTINY-Gastric02获得的结果,优赫得®(6.4mg/kg)已在全球30多个国家/地区获批,用于治疗既往接受过基于曲妥珠单抗的治疗方案的局部晚期或转移性HER2阳性胃或胃食管交界处(GEJ)腺癌成人患者。
关于德曲妥珠单抗临床开发计划
旨在评价德曲妥珠单抗单药治疗多种可靶向HER2的癌症的疗效和安全性的全面临床研发计划正在全球范围内进行。联合免疫治疗等其他抗肿瘤治疗的研究也在进行中。
关于第一三共和阿斯利康的合作
第一三共与阿斯利康分别于2019年3月和2020年7月达成全球合作,共同开发并商业化德曲妥珠单抗和datopotamabderuxtecan(Dato-DXd),在日本市场第一三共拥有各款ADC产品的独家权益。第一三共负责德曲妥珠单抗和datopotamabderuxtecan的生产和供应。
关于第一三共DXdADC产品组合
第一三共DXdADC产品组合目前主要有六款处于临床开发阶段的ADC药物,涵盖多种癌症类型。德曲妥珠单抗(靶向HER2的ADC)和datopotamabderuxtecan(Dato-DXd,靶向TROP2的ADC)目前正由第一三共与阿斯利康共同开发并在全球范围内商业化。另外四款第一三共DXdADC包括patritumabderuxtecan(HER3-DXd,靶向HER3的ADC)、ifinatamabderuxtecan(I-DXd,靶向B7-H3的ADC)、raludotatugderuxtecan(R-DXd,靶向CDH6的ADC)以及DS-3939(靶向TA-MUC1的ADC)。
每款ADC均采用第一三共独有的DXdADC技术设计,用于靶向表达特定细胞表面抗原的癌细胞,并将细胞毒性有效载荷递送至癌细胞内部。每款ADC由单克隆抗体通过可裂解四肽连接子与多个拓扑异构酶I抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成。
datopotamabderuxtecan、ifinatamabderuxtecan、patritumabderuxtecan、raludotatugderuxtecan和DS-3939均为在研药物,尚未在任何国家/地区获批用于任何适应症。尚未完全确定安全性和疗效。
关于第一三共
第一三共是一家为社会可持续发展做贡献的创新型全球医疗保健公司,致力于发现、开发和提供新的标准疗法,以提高世界各地患者的生活质量。第一三共专注制药行业120余年,凭借其世界一流的科学和技术,为癌症、心血管疾病和其他医疗需求远未得到满足的疾病患者研发新的治疗方法和创新药物。如欲了解更多信息,请访问www.daiichisankyo.com。
文献来源:
1.ASCO.BreastCancer.AccessedOctober2023.
2.IqbalN,etal.MolBiolInt. 2014;852748.
3.OmarN,etal. Pathogenesis.2015;2(3):1-9.
4.PillaiR,etal.Cancer.2017;1;123(21):4099-4105
5.NationalCancerInstitute. EnhertuMarksFirstTargetedTherapyforHER2-MutantLungCancer. AccessedOctober2023
6.SienaS,etal.AnnOncol.2018May;29(5):1108–1119
7.YanM,etal. CancerMetastasisRev. 2015;34(1):157–164.
8.BuzaN,etal.ModernPathology.2013Dec;26(12):1605-12.
9.Meric-BernstamF,etal.JClinOncol.2021;39:15: 3004-3004
