科学家打开T细胞进入肿瘤的“大门”,将血管重塑用于癌症免疫治疗,极大增强CAR-T免疫疗法敏感性
来源:DeepTech深科技
使用新型免疫学方法来治疗肿瘤,是21世纪以来的一项重大科学突破。免疫治疗中最前沿的技术之一是嵌合抗原受体(CAR,ChimericAntigenReceptor)T细胞疗法,即采用基因工程技术让免疫T细胞表达CAR,从而让T细胞精准地识别并杀伤肿瘤细胞。
目前,在治疗血液系统的肿瘤中,CAR-T免疫疗法已经取得了令人瞩目的成绩,特别是在急性B淋巴细胞白血病、淋巴癌、和多发性骨髓瘤的临床实践中。
但是,对于实体肿瘤的治疗,CAR-T免疫疗法依然未能呈现很好的效果。其中一个重要原因在于,由于肿瘤内的血管即T细胞通道已经发生病变,这给T细胞进入肿瘤带来了阻碍,以至于仅有极少量CAR-T细胞能够进入实体肿瘤。
尽管通过现有生物医学技术的改造,已能让T细胞拥有强大的抗肿瘤功能。但是,如果不能把它们输送到肿瘤内部,一切都是空谈。
打个比方,免疫治疗好比一场足球比赛,被改造好的T细胞相当于“传球”。目前最急需的临门一脚便是打开肿瘤“大门”,让T细胞进入肿瘤尽情地“发挥”即杀伤并清除肿瘤。
一旦肿瘤细胞发生病变,就会“城门失火、殃及池鱼”,肿瘤里的血管也会遭到破坏,进而会让血管发生一系列的病变,让其失去原有的输送免疫细胞功能,并会让血管分泌出很多具有免疫抑制功能的分子。而对于宿主免疫来说,这是一个非常糟糕的微环境。
肿瘤细胞和血管细胞之间的互相促进,会在病理学上形成正向的反馈机制,这会妨碍T细胞进入肿瘤。最终,在肿瘤逃脱机体免疫力的“监管”之后,就会对免疫治疗产生耐受。因此,如何改造肿瘤血管——是摆在医学研究者面前的一个亟需攻克的重大难题。
20世纪70年代,哈佛大学教授犹大·法克曼(JudahFolkman)最早提出靶向血管治疗肿瘤理论,他曾试图通过去除血管来对肿瘤进行饥饿疗法。这在当时是一个革命性理论,然而遗憾的是彼时的临床治疗效果并不理想,因为失去血管支持的肿瘤会变得更加缺氧,这会增加肿瘤细胞的侵略性,甚至让其生长得更加凶猛。
基于此,学界开始转换思路:与其清除掉血管,不如让异常的肿瘤血管变得正常化,即血管投递功能更多地发挥作用,这样一来就会有更多的T细胞进入肿瘤。
过去二十年间,在改造以及研发正常化的肿瘤血管疗法上,科学家们进行了异常艰辛的探索。其中的先驱人物之一便是哈佛大学的拉克什·贾恩(RakeshJain)教授。他所提出的理论是:既然肿瘤会分泌过多的血管促进因子比如血管内皮生长因子,从而导致血管发生异常病变,因此抑制这些因子就有可能让肿瘤血管变得正常。
毫无疑问这是一个极为创新的想法,21世纪初当它刚被提出时,还曾一度引起轰动。当时,Science、NatureMedicine等期刊纷纷发表评论表示支持。接下来的十几年里,基于上述理论的指导全球多家实验室均有尝试临床试验,主要使用的是抑制血管内皮生长因子的贝伐珠单抗(Bevacizumab)。
不幸的是,临床研究结果表明对于大多数恶性肿瘤,贝伐珠单抗并不能产生有效作用。多数情况下,人们只能观察到短暂且微弱的血管改变结果,而且该理论并不能显著促进T细胞进入肿瘤。这项失败的临床结果,让学界、业界以及肿瘤患者都倍感失望,整个肿瘤血管研究领域也因此陷入困境。

在科研“荒地”披荆斩棘,他将血管重塑用于癌症免疫治疗
十年前左右,华人学者樊懿应聘获得宾夕法尼亚大学的教职,并组建一支肿瘤研究团队,目标之一便是尝试开发重塑血管的新型治疗方案。

宾夕法尼亚大学一直被认为是基因治疗和癌症免疫治疗研究的“圣地”,这里有被誉为“CAR-T免疫治疗之父”卡尔·玖恩(CarlJune)教授在内的众多研究先驱。
而和其他免疫治疗团队不同的是,樊懿实验室并未聚焦在传统的T细胞基因改造的研究,而是着重探索肿瘤内部的微环境。也就是说,该团队是一个从事免疫治疗但却不研究免疫T细胞的课题组。
多年来,樊懿和同事致力于肿瘤、血管、免疫和干细胞之间的交叉学科的研究,其中一个研究方向便是改造肿瘤血管。
在正式开始之前,他和团队一直在思考靶向血管生长因子抗肿瘤失败的背后原因:是否是因为此前忽略了一些更重要的通路?
一番思考之后樊懿课题组决定另辟蹊径,不去关注那些外在的生长因子,转向研究内在的血管细胞基因重塑。由于此前领域内临床试验的失败,当时在肿瘤血管生物学领域里,无论是科研经费、还是人员数量都出现了大面积下滑。
再加上樊懿实验室当时提出的新理论是个冷门方向,让这支刚刚成立的课题组颇感不顺,特别是在基金申请和论文发表上。当时。甚至有同事善意地建议他们换一个热门的研究方向。
但是,樊懿给团队定下的座右铭是“放弃总是言之过早”。对他和团队来说,科研好比是大海泛舟,随波逐流固然省时省力,但是逆水行舟却更具挑战之乐。
几年之后,就在启动经费即将告罄的时候,课题组的一系列论文开始得到认可并陆续见刊,这些论文分别发表在JournalofClinicalInvestigation(JCI)、NatureCommunications、和ScienceTranslationalMedicine。
其所提出的新理论也逐渐被学界同行认可,2016年和2018年美国抗癌协会和北美血管生物学组织,分别给樊懿颁发了JudahFolkman奖和Springer奖,这也激励着他和团队继续探索于“科研无人区”。
随后,他们进行了更大胆、更全面的研究:筛选人类基因组里的所有激酶,借此发现了一个新的治疗靶点PAK4,相关论文于2021年发表在NatureCancer。
该项研究表明,抑制PAK4可以重组血管内皮细胞的基因表达,从而改善血管功能并促进T细胞进入肿瘤,在和CAR-T免疫疗法联用时可以带来显著的治疗效果。对于将血管重塑用于癌症免疫治疗来说,这是一次开创性的成功尝试。

这是一项宏大的研究,论文作者多达几十位。它基于该课题组更早之前的一个科学假设:即代谢紊乱可能是血管病变的一个决定性因素,并且有望成为一个新的治疗靶点。
但在之前,对于血管细胞在肿瘤里的代谢方式学界知之甚少。领域内几乎是一片空白,并没有成熟的研究体系可以借鉴。
樊懿说:“我的博士生张铎既有才华又有进取心,入组时他就表示愿意接受这个挑战。后来我们几乎从零开始,逐一克服在单细胞基因表达分析、转基因动物模型、以及三维血管成像等在技术和资源上的困难,耗时五年之久终于完成本次项目。”
尤其值得一提的是,在做代谢产物研究的时候,由于质谱灵敏度和通量等问题,导致他们无法有效追踪葡萄糖来源的碳转移,一度曾让分子机理研究面临中断。幸好他们得到了斯坦福大学叶江滨教授的帮助,最终精准捕捉到PHGDH调控下的细胞代谢变化。
总而言之,在这篇发表在CellMetabolism的论文里,樊懿团队首次系统性地研究了肿瘤内皮细胞的各种代谢途径的变化,并发现PHGDH介导的丝氨酸代谢是其中改变最大的通路。
通过基因敲除和药理学的方法,他们发现降低PHGDH的表达或活性,可以产生重塑血管的作用。好比园丁剪掉不好的枝条,树木就能生长得更好一样——在降低PHGDH的表达或活性之后,肿瘤里的血管也会更加顺畅,从而能让大量免疫T细胞进入肿瘤。
并且,由于PHGDH介导的代谢反应,血管内皮细胞会产生很多免疫抑制的代谢产物。这意味着抑制PHGDH也能减少血管内皮细胞在血管旁边的堆积,从而让穿过血管的T细胞具备更高的活性。
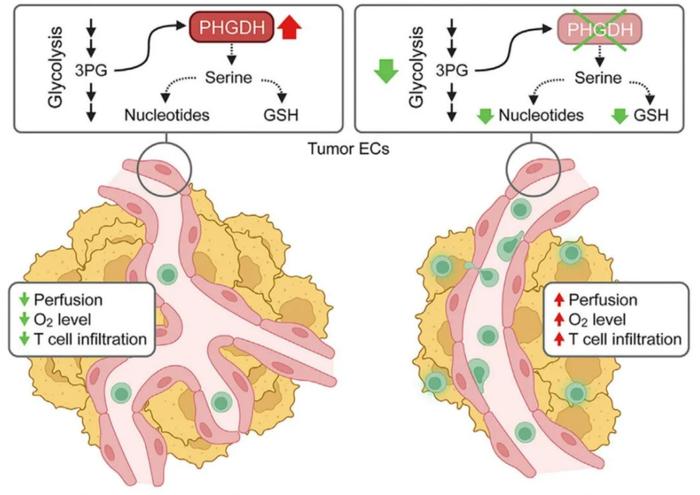
受到上述实验结果的启发,课题组将靶向PHGDH和CAR-T免疫疗法进行联合治疗,结果在两种动物肿瘤模型里都显示出不错的治疗效果。
他们发现,联合治疗可以显著抑制所有的肿瘤生长,并且能够彻底治愈大约20%左右的携带肿瘤的动物。这也是学界首次将代谢方法用于重塑血管和肿瘤免疫治疗,因此他们希望未来在人体临床实验里也能看到显著的治疗效果。
另据悉,通过本次研究该团队发现了一个新的血管代谢靶点,并发现其对肿瘤免疫具备直接的调控作用。对于大多数实体肿瘤来说,目前的CAR-T免疫疗法均未起到较好的疗效。以此,他们希望通过CART免疫疗法联用本次研发的代谢治疗法,给恶性肿瘤的临床治疗带来有效策略。
考虑到该成果的潜在临床价值,针对相关小分子抑制剂、以及实验室开发的大分子纳米核酸颗粒药物,课题组已经申请了国际专利。樊懿非常希望这项成果可以迅速转化,为恶性实体肿瘤患者带来新的药物。

1.Zhang,D.,Li,A.M.,Hu,G.,Huang,M.,Yang,F.,Zhang,L.,...&Fan,Y.(2023).PHGDH-mediatedendothelialmetabolismdrivesglioblastomaresistancetochimericantigenreceptorTcellimmunotherapy.CellMetabolism,35(3),517-534.

