指南循证视角下的研发决策:来自文献挖掘的启示
转自:医药魔方Plus
2023年8月24日至25日,由医药魔方主办的“2023中国医药决策者峰会暨第三届医药魔方开放日”成功举办,80+位医药领域专家分享,40+场主题演讲,8场精彩论坛。在8月25日的研发决策分论坛上,医药魔方高级解决方案专家简渝苏博士,从非小细胞肺癌(NSCLC)领域出发,和大家分享了名为“指南循证视角下的研发决策”的主题演讲。

创新需要精神,也需要土壤,更需要正确的导向
众所周知,药物研发是一个复杂的过程。有人总结出新药研发的三个“10”定律:研发需10年,花费需10亿美元,成功率只有10%。因此,面对这样一个周期长、投入高、风险高的过程,其中的每一个决策点都至关重要。今天的分享,并没有太多非常具体的方法论,而是从NSCLC指南循证的视角,结合一些研发故事,一起帮助大家探寻未满足的临床需求。
指南视角下的药物应用全景

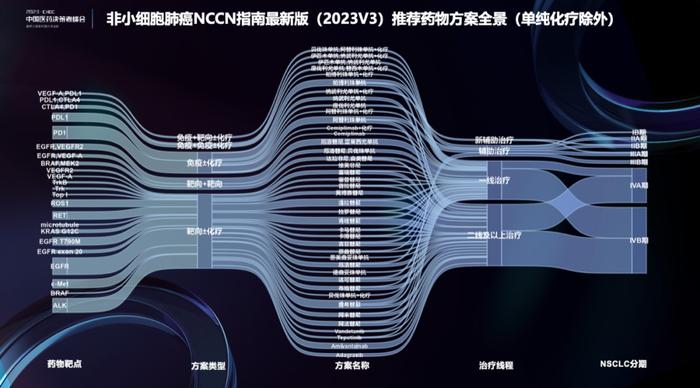
下图数据基于NCCNNSCLC2023V3版指南所有推荐治疗方案,由于篇幅的限制,去除了单纯化疗的方案。图的中间列是治疗方案名称,左侧是治疗方案类型和药物靶点。右侧是治疗线程和NSCLC分期。举例来说,在该指南中,三代EGFR抑制剂奥希替尼同时被推荐用于辅助、晚期一线、二线及以上的治疗中。此外,免疫检查点抑制剂如帕博利珠单抗、纳武利尤单抗和阿替利珠单抗都已经被推荐用于围手术期的新辅助或辅助治疗。
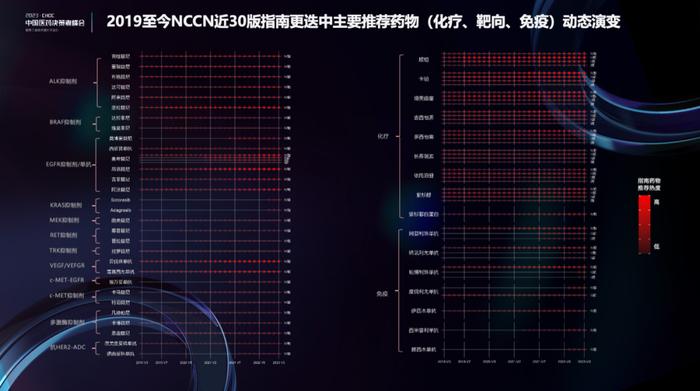
第二张图展示了从2019年至今NCCN指南推荐治疗方案的历史迭代情况。药物后的红点越深,代表在指南中的推荐频次越高。可以看到很多药物,随着时间的推移,红点的颜色逐渐加深,提示循证证据的增加,同时也可看到部分药物适应症的扩展。2020年后,多个备受关注的新型抗肿瘤药物进入指南,例如莫博赛替尼、埃万妥单抗、德曲妥珠单抗等。
第三张图用对比的形式,展示了CSCO(2022)和NCCN(2023V3)指南的药物推荐情况。一方面,在CSCO指南中,例如信迪利单抗、阿美替尼、卡瑞利珠单抗等多个国产创新药获得推荐。另一方面,与CSCO指南相比,NCCN指南独有的推荐药物数量并不是很多(注:仅在NSCLC范围内),例如替西木单抗、vandetanib,这也显示出近些年国内新药获批速度的明显加快。

循证视角下的临床研发动态

基于DeepMed数据库循证数据板块,归纳整理2003年至2022年高质量文献结果。高质量,是指高影响因子的期刊,以及国际知名医学会议上发表的数据结果,并用AI+HI(人类智能)进行分析,共有~8000篇高质量文献,得到了下面这两张图,左图展示靶点的研发动态,右图是药物的研发动态,均选取了2022年Top100结果。红点的颜色越深,代表循证文献的数量越多。
靶点研发动态图上,2022年的TOP3分别是:PD-1,PD-L1和EGFRT790M。近五年新出现的热门靶点有:EGFRexon20、EGFRC797S、LAG3、RET等。药物研发动态图上,TOP3分别是:帕博利珠单抗,奥希替尼和纳武利尤单抗。TOP10药物中,过半都是PD-1/PD-L1抑制剂。近些年,还有一些循证证据显著增加的药物,例如:洛拉替尼、amivantamab等。也有循证证据数量减少的例子,例如:克唑替尼、西妥昔单抗等“老”药。
再来看一个具体药物的例子——经典三代EGFR抑制剂奥希替尼。2015年11月,基于AURA系列研究,奥希替尼获批用于既往接受过EGFR抑制剂后进展、并伴有T790M突变的NSCLC患者;2018年4月,基于FLAURA研究,奥希替尼获批用于EGFR突变晚期NSCLC的一线治疗;2020年12月,基于ADAURA研究,获批用于可手术NSCLC的辅助治疗。
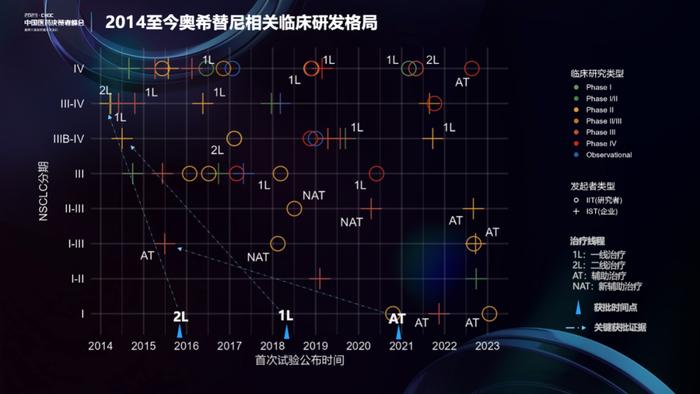
当然,奥希替尼的探索远不止这些。下面是一张五维图。首先,横轴代表时间线;第二,纵轴代表NSCLC的疾病分期;第三,用颜色区分临床研究类型,绿色为I期临床试验,黄色II期,红色III期等;第四,圆圈(IIT,研究者发起)和十字(IST,企业发起)代表研究发起者类型;最后,对治疗线程也进行了标注,AT为辅助治疗,NAT为新辅助等。
从上面这张图中可以看到,奥希替尼的探索从疾病晚期阶段开始,在各治疗线程中,开展较早的多为IST,而在产品上市以后,IIT研究数量快速增加。我们单独挑了三个比较有意思的研究点,数据显示,最早开展奥希替尼新辅助治疗研究的是IIT而不是IST。2018年2月,美国加利福尼亚大学开展了一项IIT新辅助治疗小样本研究(NCT03433469),结果在2023年ASCO年会上公布。2018年7月,北京大学肿瘤医院也发起了一项小样本量的新辅助奥希替尼治疗研究(ChiCTR1800016948),目前尚未公布结果。而阿斯利康公司发起的IST研究在2020年(NCT04351555),计划样本量300+。这也反映了IIT和IST是一个相辅相成的关系,在做研发决策时,同类其他产品的研发动态可以作为很好的参考。
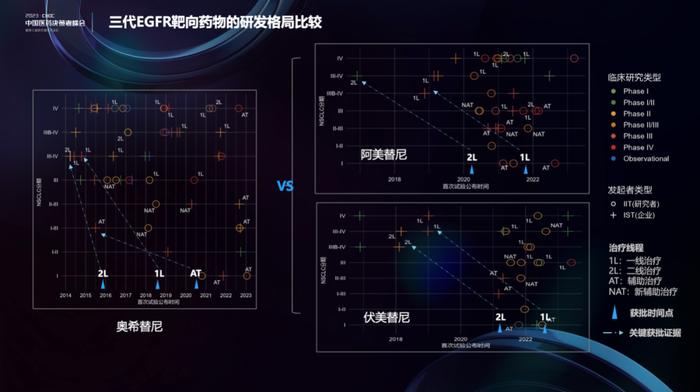
目前全球已经有6款三代EGFR抑制剂上市(奥希替尼,阿美替尼,伏美替尼,贝福替尼,lazertinib,olmutinib),我们同时制作了阿美替尼和伏美替尼的研发动态图。两者的研发动态类似,非常积极的开始了新辅助治疗的布局。
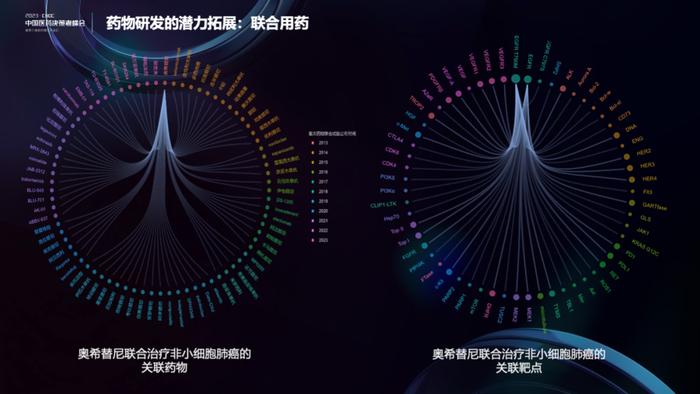
作为药物研发潜力的拓展,下图展示了联合用药和联合靶点的趋势。如果有需要,可以在DeepMed循证数据和联合疗法板块挖掘更多的信息。联合用药的应用场景,多是为了解决三代EGFR抑制剂治疗后耐药的问题。
回归临床价值,失败不是终点
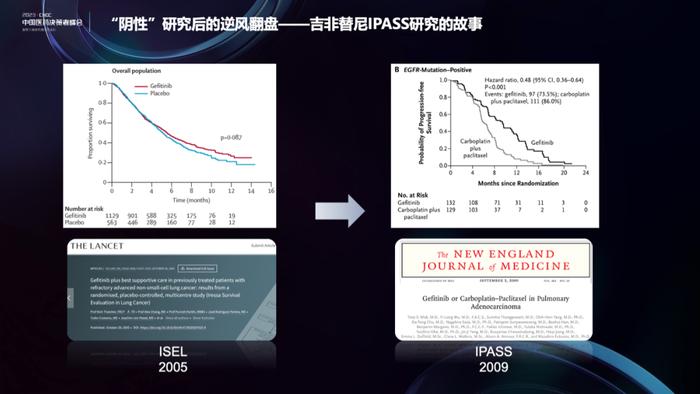
说到失败临床研究,来说一代EGFR抑制剂吉非替尼(易瑞沙)的故事,它的成功背后经历了波折。吉非替尼于2003年获得FDA加速批准(AA),用于治疗既往接受过化疗后进展的晚期NSCLC患者。但是,其III期确证性研究ISEL结果显示,与安慰剂相比,吉非替尼未能改善患者的生存期。这个结果使得吉非替尼在欧盟撤回了上市申请,FDA也修改了适应症。需要注意的是,ISEL研究的主要终点针对非选择人群,而预先计划的亚组分析提示,在不吸烟和亚洲患者中,接受吉非替尼治疗有获益优势。包括吴一龙教授、TonyMok教授在内的亚洲专家们,策划了具有里程碑意义的IPASS研究,纳入非吸烟和轻度吸烟的肺腺癌亚裔患者,并进行包括EGFR在内的生物标记物分析。研究结果显示,在EGFR突变患者中,吉非替尼单药显著优于化疗。该研究于2009年在NEJM发表结果,拉开了EGFR抑制剂的序幕。这也引出了我们的主题——失败不是终点。

去分析这些研发决策者的思路,可以看到这里面有非常重要的因素,就是NSCLC的人群特点。流行病学显示,不仅在吸烟史,还有分子分型,东西方人群存在显著差异。
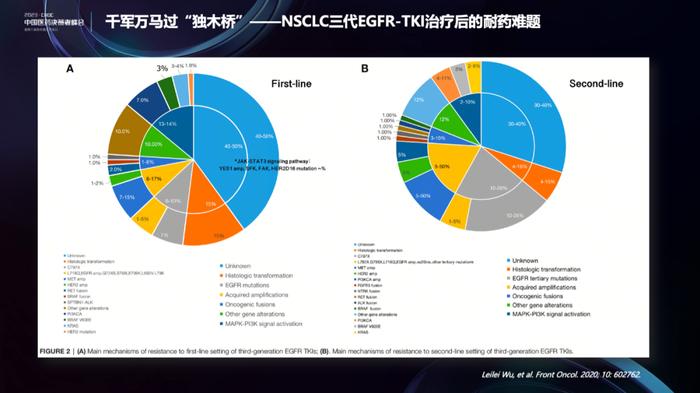
再来看另外一个例子,主题是耐药。每一个药物治疗后的耐药,都有非常复杂的耐药机制,就以EGFR抑制剂为例,三代药物作为一线和二线用药后的耐药机制并不完全相同,一线的耐药机制留有更多空白,仍有40~50%的耐药机制不明。总体上,可分为EGFR依赖性(on-target)和EGFR非依赖(off-target)耐药。EGFR依赖性耐药机制中,C797S/G和L718Q占比较高;EGFR非依赖性耐药机制中,主要包括MET扩增、HER2扩增、MAPK-PI3K通路激活、组织学转化等。
除了机制的结果,是否可以去看目前奥希替尼耐药相关的已发表的循证文献,作为先驱者走过的路,一定会给大家带来很多启示。
如果要整理大量的循证文献,传统方法需要在不同的数据源中搜索,用多种组合的检索方式锁定关键词,然后一一浏览疗效和安全性数据。而基于医药魔方大数据引擎,用耐药、进展和治疗失败为关键词,批量过滤奥希替尼在2018~2023年间的相关文档,用AI+HI的结构化能力,批量将海量文献证据进行自定义指标抽提,最终从7000+篇文献中精准定位100+篇核心临床文献,最终形成耐药为主题的结构化证据集。
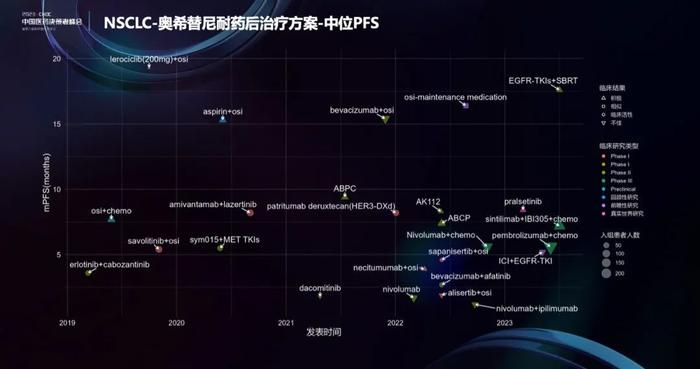
下面两张图就是文献结构化处理后的结果。首先,是展示奥希替尼耐药后治疗方案的ORR结果。探索的方案非常多样,既有免疫+抗血管、双免疫等联合方案,也有是一些新兴的靶点,例如:HER3、AuroraA、mTOR等。总体来说,这些文献结果的发表,多集中在近三年。

第二张是PFS结果图,ORR的改善能否转化为PFS生存获益,也是肿瘤领域临床试验上常提及的问题。

第三张图整合了ORR和PFS结果,红圈中整体结果不佳,包括了近期公布的几个曾经被寄予厚望的III期免疫治疗研究,比如Checkmate722(纳武利尤单抗)、Keynote-789(帕博利珠单抗+化疗)。

临床研究失败了后该怎么办?就放弃了?不再探索这个方向的路了?其实,我们可以通过对这些失败研究的分析回顾,吸取经验教训,例如细分适应症人群,研究的主要终点为阴性,是否某细分人群亚组有获益趋势?就以EGFR耐药后的免疫失败研究为例,现有数据提示EGFRexon19和L858突变者对免疫治疗的应答或存在不同。这里也需要强调的是,亚组分析结果要谨慎对待,它的主要意义是给未来的临床研究提出新的假设。
这里是2016年发表在NEJM非常经典的一篇综述:theprimaryoutcomesfails,whatnext?这里列出了12个思考(下图)。上面这两个故事可以和第4点和第8点呼应。

最后我们想用这张图来给今天的分享做一个简单总结。这张图参考自药学顶级期刊DrugDiscoveryToday的一篇文章。临床需求的评估是一个动态变化的过程,不断满足患者的临床需求,是新药研发的终点,也是起点。这张图的最左侧是患者的疾病状态,最右侧是理想的无病状态。从患者角度来看,如果没有可用的治疗方法,显然存在未满足的临床需求。如果有标准治疗方法,则当前的治疗标准(SoC)决定了该适应症下的剩余未满足的临床需求(即个体与理想健康之间的差异)。当一个新产品进入市场时,“未来未满足的临床需求”以及它解决未满足需求的程度将对患者产生重大影响。“未来未满足的临床需求”由未来SoC决定。
为了对“未来未满足的临床需求”进行合理评估,详细了解和定义适应症和目标人群是关键。当疾病出现进展,疾病的不同阶段或不同的治疗方法也需要考虑在内。在许多情况下,还存在地区差异以及不同的患者亚群,这些差异会影响评估中要考虑的SoC,从而也会影响产品的临床开发策略。该过程中需对竞争格局进行分析,以了解相关竞争对手资产可能实现的额外净临床效益,并评估时间框架和这些资产进入市场的可能性。随着基因或细胞疗法等新技术的进步,还可能需要考虑在某些疾病领域内进行持续性和长期的治疗。
回到开头时提到的,我们需要不断的回归到临床价值本身,思考药物研发的终点到底是什么样子,不论是成功还是失败的经验,都能从中收获成长。希望每一位研发决策者都能够保持“以患者为中心”的初心,不忘初心,方得始终。
