【喜报】普利制药独家规格盐酸多巴酚丁胺注射液获得中国一致性评价批准
转自:普利制药300630
普利制药独家规格
盐酸多巴酚丁胺注射液
获得中国一致性评价批准

继盐酸多巴酚丁胺注射液双规格(20ml:250mg和40ml:500mg)获批上市后,近日,普利制药收到国家药品监督管理局签发的盐酸多巴酚丁胺注射液(1.6ml:20mg)的药品一致性评价注册批件。产品的多规格获批能满足不同临床用药需求,有利于提升该药品的市场竞争力,对公司的经营业绩产生积极影响。
一、药品基本情况
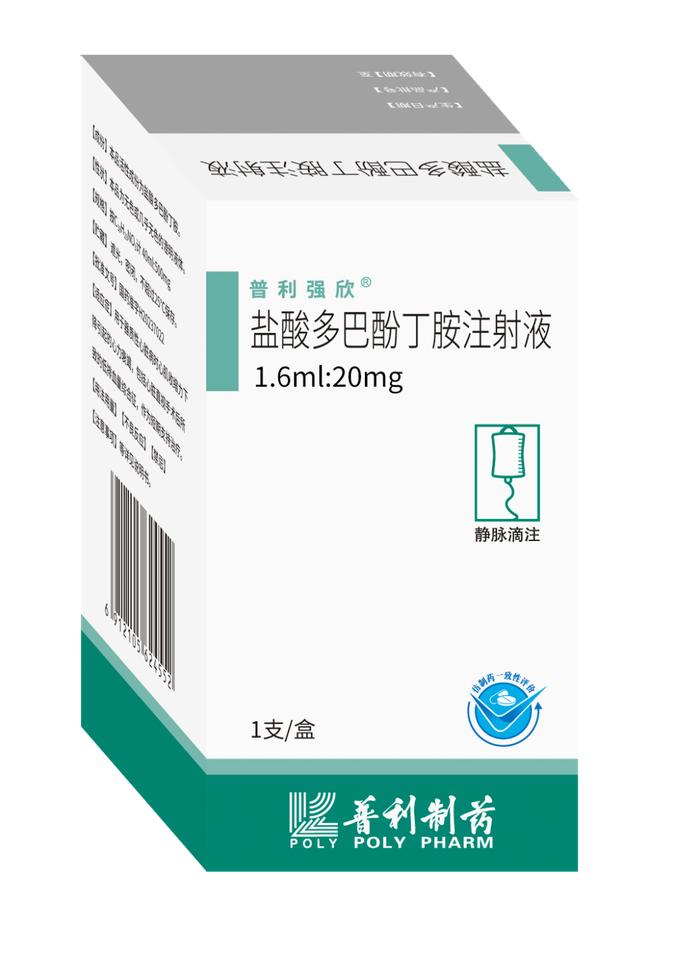
药品名称:盐酸多巴酚丁胺注射液
适应症:用于器质性心脏病时心肌收缩力下降引起的心力衰竭,包括心脏直视手术后所致的低排血量综合征,作为短期支持治疗。
剂型:注射剂
规格:1.6ml:20mg
药品批准文号:国药准字H20237157
药品上市许可持有人及生产企业:海南普利制药股份有限公司
二、满足不同临床用药需求
根据盐酸多巴酚丁胺注射液说明书显示,适应症为用于器质性心脏病时心肌收缩力下降引起的心力衰竭,包括心脏直视手术后所致的低排血量综合征,作为短期支持治疗。
成人常用量将多巴酚丁胺加于5%葡萄糖液或0.9%氯化钠注射液中稀释后,以滴速每分钟2.5~10ug/kg给予。盐酸多巴酚丁胺注射液(1.6ml;20mg)可实现灵活给药,满足部分患者的短期支持治疗。
三、中美共线,原料制剂一体化
多巴酚丁胺是用于治疗心力衰竭和心源性休克的拟交感神经药物。由美国ELILILLYANDCO公司开发,1978年7月18日获得FDA批准上市(商品名:DOBUTREX®,12.5mg/ml,NDA号:N017820)。此后,盐酸多巴酚丁胺注射液陆续在中国,日本,欧洲等国家批准上市。
普利制药的盐酸多巴酚丁胺注射液20ml:25mg和40ml:500mg两个规格成功研发后,相继递交了美国和中国的仿制药注册申请,于2022年12月收到美国食品药品监督管理局(FDA)的批准通知,于2023年3月收到国家药品监督管理局的一致性评价批准通知。1.6ml:20mg规格成功研发后,递交了中国的仿制药一致性评价补充申请;近日,公司收到国家药品监督管理局的一致性评价批准通知。
随着公司盐酸多巴酚丁胺注射液(规格:1.6ml:20mg)通过仿制药注射剂一致性评价,丰富了产品多临床应用场景,有利于树立较高竞争壁垒,提升该药品的市场竞争力,对公司的经营业绩产生积极影响。
另外普利制药自产盐酸多巴酚丁胺原料药,为公司原料制剂一体化品种。
四、全规格覆盖,市场前景广阔
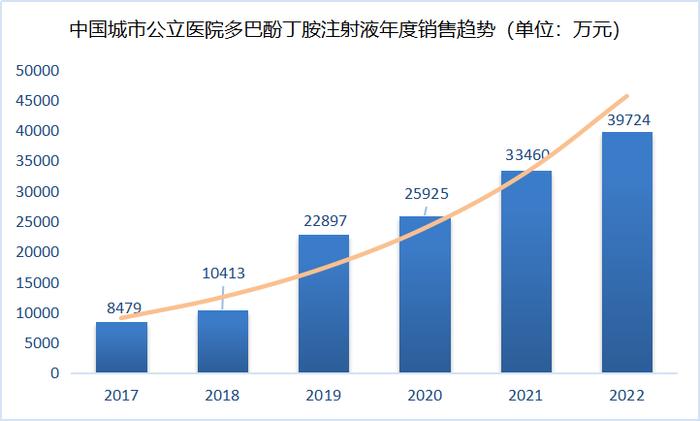
根据米内网数据(详见下图)显示,近年来盐酸多巴酚丁胺注射剂的国内市场呈现稳步增长态势,2022年销售额超5亿元人民币,5年平均年增长率超40%。
此次获批上市的盐酸多巴酚丁胺注射液(1.6ml:20mg)为国内临床常用含量,能灵活满足临床各类治疗需求,具备优秀的临床价值,在未来将发挥巨大临床作用。

高品质,普利造!
海南普利制药股份有限公司1992年成立于海口,是中国医药制剂国际化先导企业和国家工信部智能制造示范企业,已被国家工信部纳入工业转型升级中国制造2025年儿童药重点项目企业。2017年在创业板上市后,短短3年已成为中国上市公司科技创新百强企业。
公司从事药品国际化开拓以来,至今已获得了150余个国际制剂上市许可,产品远销世界各地。
未来,普利制药将一如既往地实施“先进高端制造,面向国内国际”的全球战略,持续不断研发更多更好的药物;走向世界,为民族医药工业的强大持续作出贡献,让中国老百姓用上出口欧美的高品质药品。
