恒瑞 吡咯替尼、诺程建华 奥布替尼已获中国药监局批准新适应症
转自:药时代
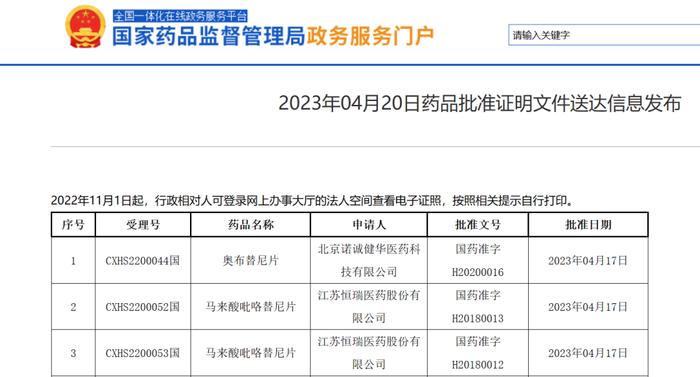

2023年4月21日,中国药监局官网显示,恒瑞医药马来酸吡咯替尼片新适应症上市申请已获批准。本次获批新适应症为:与曲妥珠单抗和多西他赛联合,用于治疗表皮生长因子受体2(HER2)阳性、晚期阶段未接受过抗HER2治疗的复发或转移性乳腺癌患者。
本次获批基于试验编号为HR-BLTN-Ⅲ-MBC-C的3期临床研究。
是一项评价马来酸吡咯替尼片联合曲妥珠单抗和多西他赛对比安慰剂联合曲妥珠单抗和多西他赛一线治疗HER2阳性复发/转移性乳腺癌的有效性和安全性的随机、双盲、平行对照、多中心Ⅲ期临床研究(NCT03863223)。
根据ESMO年会上恒瑞所作报告,本研究共入组590例受试者,按照1:1随机入组,分别接受吡咯替尼联合曲妥珠单抗和多西他赛治疗(试验组)或安慰剂联合曲妥珠单抗和多西他赛治疗(对照组),中位随访时间分别为15.8个月和14.9个月。
主要研究终点是研究者评估的无进展生存期(PFS),次要研究终点包括独立影像评估委员会(IRC)评估的PFS、总生存期(OS)、总缓解率(ORR)、临床获益率(CBR)、客观缓解持续时间(DOR)和安全性。
吡咯替尼组和对照组的独立评审委员会评估的无进展生存期(PFS)分别达33.0个月和10.4个月,总缓解率(ORR)分别为82.8%和70.6%,中位客观缓解持续时间(DOR)分别为25.9个月和9.5个月。

引上海证券交易所消息,目前国内外已上市用于乳腺癌治疗的HER2小分子抑制剂有Lapatinib(商品名Tykerb)、Neratinib(商品名Nerlynx)和Tucatinib(商品名Tukysa)。
2021年Lapatinib、Neratinib、Tucatinib全球销售额合计约为6.87亿美元。截至目前,马来酸吡咯替尼相关项目累计已投入研发费用约为112,412万元。

诺诚健华昨日宣布,诺诚健华自主研发的新型BTK(布鲁顿酪氨酸激酶)抑制剂奥布替尼(产品名:宜诺凯®)获得中国国家药品监督管理局(NMPA)批准,用于治疗复发/难治性边缘区淋巴瘤(MZL)患者。奥布替尼由此成为中国首个且唯一获批针对MZL适应症的BTK抑制剂,也是奥布替尼在中国获批的第三个适应症。
奥布替尼于2020年12月25日在中国附条件获批,用于治疗复发/难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)、以及复发/难治性套细胞淋巴瘤(MCL) 两项适应症。
边缘区淋巴瘤(MZL)是一类惰性B细胞非霍奇金淋巴瘤(NHL),是我国第二常见的淋巴瘤,约占所有淋巴瘤的8.3%,主要影响中老年人群,年发病率在全球范围内呈上升趋势。经过一线治疗后,疾病进展/复发的MZL患者仍缺乏有效的治疗手段。

