【原创】一文收藏最新国家药监局已明确落地实施的ICH指导原则清单
转自:注册圈
2023年是中国药品监督管理局(NMPA)加入ICH的第七个年头,近期,国家药监局在北京召开ICH中国进程与展望座谈会,与国内外行业协会代表共话发展与合作,本文简单梳理回顾中国如何布局加入ICH的来龙去脉,并梳理中国精准转化落地ICH指导原则现状,如有遗漏,欢迎留言补充。
一
中国如何布局加入ICH?
ICH(国际人用药品注册技术协调会)是一个技术性非政府组织,是药品领域极其重要的国际组织,主要是协调各国的药品注册技术要求,使药品生产厂家能够应用统一的注册资料,提高新药研发、注册、上市的效率,笔者梳理了中国布局加入ICH的一些里程碑事件。
(1)2014年11月,被业界称为中国加入ICH的起点,当年在里斯本召开ICH会议,原国家食品药品监督管理总局(CFDA)国际合作司向ICH管理委员会传递了CFDA加入ICH的积极态度。
(2)2017年6月,CFDA成为ICH监管机构正式成员,ICH第一次会议在加拿大蒙特利尔召开,会议通过了中国国家食品药品监督管理总局的申请,中国药品的监管与开发正式步入国际舞台,中国国家药监部门深度参与全球药品安全治理,持续深化国际合作。
(3)2017年7月12日,原食药监总局成立ICH工作办公室,负责药监局ICH工作统筹协调,确保各项工作有序开展;负责ICH相关会议组织管理;负责ICH技术指南的起草、转化与实施;负责与ICH联络、协调;其他与ICH相关的工作。
(4)2018年6月7日,NMPA当选为ICH管理委员会成员,在日本神户举行的2018年ICH第一次大会上,NMPA成为ICH管委会成员,积极与国际同行互鉴互享,加快监管规则的协调与统一,推进国际监管互认,共促全球医药产业发展。
二
国家药监局已明确落地实施的ICH指导原则清单
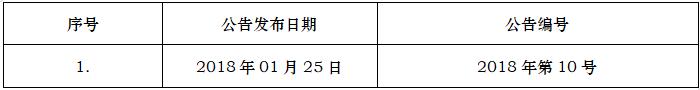
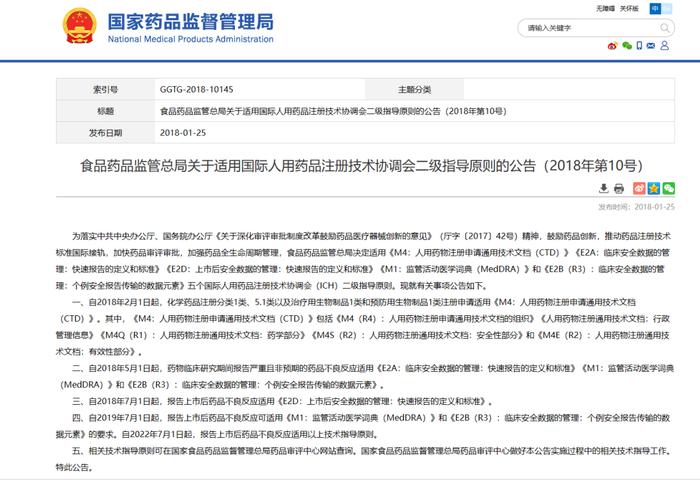
ICH的转化实施的标准要求遵照ICH指导原则的相关要素、概念和原则,需要优先参考实施ICH原文或者翻译指导原则原文。2018年1月25日,中国国家食品药品监督管理总局(CFDA)发布——关于适用国际人用药品注册技术协调会二级指导原则的公告(2018年第10号),意味着我国药品注册管理制度与国际全面接轨,截至2023年9月,笔者统计NMPA累计发布近19个公告,涉及ICH指导原则清单及转换落地的时间如下:
ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
E2A
临床安全数据的管理:快速报告的定义和标准
E2AClinicalSafetyDataManagement:DefinitionsandStandardsforExpeditedReporting
1994-10-27
2018/05/01
E2B(R3)
临床安全数据的管理:个例安全报告传输的数据元素
E2B(R3)ClinicalSafetyDataManagement:DataElementsforTransmissionofIndividualCaseSafetyReports(ICSRs)
2012-11-01
2018-05-01
E2D
上市后安全数据的管理:快速报告的定义和标准
E2DPost-ApprovalSafetyDataManagement:DefinitionsandStandardsforExpeditedReporting
2003-11-12
2018/07/01
M1
监管活动医学词典(MedDRA)
M1MedDRA-MedicalDictionaryforRegulatoryActivities
1999-01-01
2022-07-01
M4(R4)
人用药物注册申请通用技术文档的组织
M4(R4):OrganizationoftheCommonTechnicalDocumentfortheRegistrationofPharmaceuticalsforHumanUse
2016-06-15
2018-02-01
M4Q(R1)
人用药物注册通用技术文档:药学部分
M4Q(R1):TheCommonTechnicalDocumentfortheRegistrationofPharmaceuticalsforHumanUse:Quality–M4Q(R1)
2012/9/12
2018-02-01
M4S(R2)
人用药物注册通用技术文档:安全性部分
M4S(R2):TheCommonTechnicalDocumentfortheRegistrationofPharmaceuticalsforHumanUse:Safety–M4S(R2)
2002-12-20
2018-02-01
M4E(R2)
人用药物注册通用技术文档:有效性部分
M4E(R2):Efficacy-M4E(R2)
2012/9/12
2018-02-01
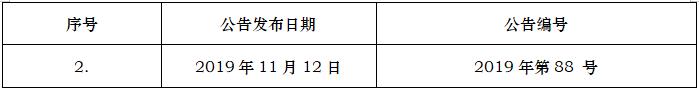

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
E1
用于评估长期治疗非危及生命性疾病的药物临床安全性的人群暴露程度
E1TheExtentofPopulationExposuretoAssessClinicalSafetyforDrugsIntendedforLong-TermTreatmentofNon-LifeThreateningConditions
1994-10-27
2022-11-12
E2E
药物警戒计划
E2EPharmacovigilancePlanning
2004-11-18
2020-02-12
E2F
研发期间安全性更新报告及示例
E2FDevelopmentSafetyUpdateReport
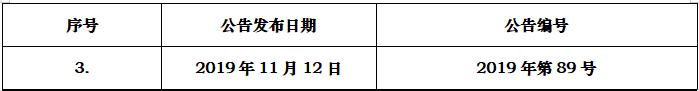
2010-08-17
2019/11/12
E3
临床研究报告的结构与内容
E3StructureandContentofClinicalStudyReports
1995-11-30
2020/05/12
E3问答(R1)
临床研究报告的结构与内容问答
E3Q&As(R1)Questions&Answers:StructureandContentofClinicalStudyReports
2012-07-06
2020/05/12
E4
药品注册所需的量效关系信息
E4Dose-ResponseInformationtoSupportDrugRegistration
1994-03-10
2020/05/12
E5(R1)
接受国外临床试验数据的种族因素
E5Q&As(R1)Questions&Answers:EthnicFactorsintheAcceptabilityofForeignClinicalData
2006-06-02
2019/11/12
E5问答(R1)
接受国外临床试验数据的种族因素问答
E5(R1)EthnicFactorsintheAcceptabilityofForeignClinicalData
1998-02-05
2019/11/12
E7
特殊人群的研究:老年医学
E7StudiesinSupportofSpecialPopulations:Geriatrics
1993-06-24
2020/05/12
E7问答
特殊人群的研究:老年医学问答
E7Q&AsQuestions&Answers:StudiesinSupportofSpecialPopulations:Geriatrics
2010-07-16
2020/05/12
E8
临床试验的一般考虑
E8GeneralConsiderationsforClinicalTrials
1997-07-17
2020/05/12
E9
临床试验的统计学原则
E9StatisticalPrinciplesforClinicalTrials
1998-02-05
2020/05/12
E10
临床试验中对照组的选择和相关问题
E10ChoiceofControlGroupandRelatedIssuesinClinicalTrials
2000-07-20
2020/05/12
E11(R1)
儿童用药品的临床调查(增补)
E11(R1)Addendum:ClinicalInvestigationofMedicinalProductsinthePediatricPopulation
2017-08-18
2020/05/12
E16
药物或生物技术产品开发相关的生物标志物:资格认定申请的背景资料、结构和格式
E16BiomarkersRelatedtoDrugorBiotechnologyProductDevelopment:Context,StructureandFormatofQualificationSubmissions
2010-08-20
2020/05/12
E17
多区域临床试验计划与设计的一般原则
E17GeneralprinciplesforplanninganddesignofMulti-RegionalClinicalTrials
2017-11-16
2019/11/12

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
S1A
药物致癌性试验必要性指导原则
S1ANeedforCarcinogenicityStudiesofPharmaceuticals
1995-11-29
2020/05/01
S1B
药物致癌性试验
S1BTestingforCarcinogenicityofPharmaceuticals
1997-07-16
2020/05/01
S1C(R2)
药物致癌性试验的剂量选择
S1C(R2)DoseSelectionforCarcinogenicityStudiesofPharmaceuticals
2008-03-11
2020/05/01
S2(R1)
人用药物遗传毒性试验和结果分析指导原则
S2(R1)GuidanceonGenotoxicityTestingandDataInterpretationforPharmaceuticalsIntendedforHumanUse
2011-11-09
2020/05/01
S3A
毒代动力学指导原则说明:毒性研究中的全身暴露量评价
S3ANoteforGuidanceonToxicokinetics:TheAssessmentofSystemicExposureinToxicityStudies
1994-10-27
2020/05/01
S3A问答
毒代动力学指导原则说明:毒性研究中的全身暴露量评价问答
S3AQ&AsQuestionsandAnswers:NoteforGuidanceonToxicokinetics:TheAssessmentofSystemicExposure-FocusonMicrosampling
2017-11-16
2020/05/01
S3B
药代动力学:重复给药的组织分布研究指导原则
S3BPharmacokinetics:GuidanceforRepeatedDoseTissueDistributionStudies
1994-10-27
2020/05/01
S4
毒代动力学指导原则说明:毒性研究中的全身暴露量评价问答
S4DurationofChronicToxicityTestinginAnimals(RodentandNonRodentToxicityTesting)
1998-09-02
2020/05/01
S6(R1)
生物制品的临床前安全性评价
S6(R1)PreclinicalSafetyEvaluationofBiotechnology-DerivedPharmaceuticals
2011-06-12
2020/05/01
S7A
人用药品安全药理学试验指导原则
S7ASafetyPharmacologyStudiesforHumanPharmaceuticals
2000-11-08
2020/05/01
S7B
人用药品延迟心室复极化(QT间期延长)潜在作用的非临床评价指导原则
S7BTheNon-ClinicalEvaluationofthePotentialforDelayedVentricularRepolarization(QTIntervalProlongation)byHumanPharmaceuticals
2005-05-12
2020/05/01
S8
人用药物免疫毒性研究
S8ImmunotoxicityStudiesforHumanPharmaceuticals
2005-09-15
2020/05/01
S9
抗肿瘤药物非临床评价指导原则
S9NonclinicalEvaluationforAnticancerPharmaceuticals
2009-11-18
2020/05/01
S9问答
抗肿瘤药物非临床评价指导原则问答
S9 Q&AsQuestionsandAnswers:NonclinicalEvaluationforAnticancerPharmaceuticals
2018-04-27
2020/05/01
S10
药物光安全评价
S10PhotosafetyEvaluationofPharmaceuticals
2013-11-13
2020/05/01


ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
Q8(R2)
药品研发
Q8(R2)PharmaceuticalDevelopment
2009-08-01
2020/01/21
Q8/9/10问答(R4)
关于Q8、Q9和Q10的问与答(R4)
Q8/9/10Q&As(R4)Q8/Q9/Q10-Implementation
2010-11-11
2020/01/21
Q9
质量风险管理
Q9QualityRiskManagement
2005-11-09
2020/01/21
Q10
药品质量体系
Q10PharmaceuticalQualitySystem
2008-06-04
2020/01/21
Q11
原料药开发和生产指导原则(化学实体和生物技术/生物实体药物)
Q11DevelopmentandManufactureofDrugSubstances(ChemicalEntitiesandBiotechnological/BiologicalEntities)
2012-05-01
2020/01/21
Q11问答
原料药开发和生产指导原则(化学实体和生物技术/生物实体药物)问答
Q11Q&AsQuestions&Answers:SelectionandJustificationofStartingMaterialsfortheManufactureofDrugSubstances
2017-08-23
2020/01/21


ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
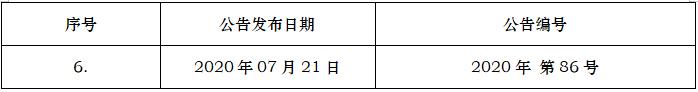
Q2(R1)
分析方法验证指导原则
Q2(R1)ValidationofAnalyticalProcedures:TextandMethodology
2005-11-01
2020/07/21
Q3A(R2)
新药原料药中的杂质研究指导原则
Q3A(R2)ImpuritiesinNewDrugSubstances
2006-10-25
2020/07/21
Q3B(R2)
新药制剂中的杂质研究指导原则
Q3B(R2)ImpuritiesinNewDrugProducts
2006-06-02
2020/07/21
Q3C(R7)
杂质:残留溶剂的指导原则
Q3C(R7)GuidelineforResidualSolvents
2018-10-15
2020/07/21
Q3D(R1)
元素杂质的指导原则
Q3D(R1)GuidelineforElementalImpurities
2019-03-22
2020/07/21
Q5A(R1)
来源于人或动物细胞系的生物技术产品的病毒安全性评价
Q5A(R1)ViralSafetyEvaluationofBiotechnologyProductsDerivedfromCellLinesofHumanorAnimalOrigin
1999-09-23
2020/07/21
Q5B
源自重组DNA技术的蛋白质产品的表达载体分析
Q5BAnalysisoftheExpressionConstructinCellsUsedforProductionofr-DNADerivedProteinProducts
1995-11-30
2020/07/21
Q5C
生物技术/生物制品质量:生物技术/生物制品稳定性试验
Q5CQualityofBiotechnologicalProducts:StabilityTestingofBiotechnological/BiologicalProducts
1995-11-30
2020/07/21
Q5E
生物技术产品/生物制品在生产工艺变更前后的可比性
Q5EComparabilityofBiotechnological/BiologicalProductsSubjecttoChangesintheirManufacturingProcess
2004-11-18
2020/07/21
Q6A
质量标准:化学药物的新药原料药和新药制剂的检测方法和可接受标准
Q6ASpecifications:TestProceduresandAcceptanceCriteriaforNewDrugSubstancesandNewDrugProducts:ChemicalSubstances
1999-10-06
2020/07/21
M7(R1)
为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制
M7(R1)AssessmentandControlofDNAReactive(Mutagenic)ImpuritiesinPharmaceuticalstoLimitPotentialCarcinogenicRisk
2017-06-01
2020/07/21

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
E2C(R2)
上市药品定期安全性更新报告
E2C(R2)PeriodicBenefit-RiskEvaluationReport
2012-12-17
2020/07/21
E2C(R2)问答
上市药品定期风险效益评估报告
E2C(R2)Q&AsQuestions&Answers:PeriodicBenefit-RiskEvaluationReport
2014-03-31
2020/07/21

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
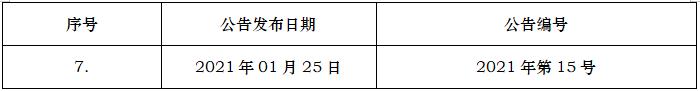
S5(R3)
人用药物生殖与发育毒性检测
S5(R3)RevisionofS5GuidelineonDetectionofToxicitytoReproductionforHumanPharmaceuticals
2020-02-18
2021-01-25
S11
支持儿科用药开发的非临床安全性评价
S11NonclinicalSafetyTestinginSupportofDevelopmentofPaediatricMedicines
2020-04-14
2021-01-25


ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
E9(R1)
临床试验中的估计目标与敏感性分析
E9(R1)Addendum:StatisticalPrinciplesforClinicalTrials
2019-11-20
2022/01/25

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
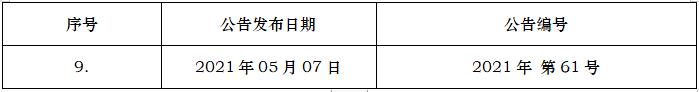
Q5D
用于生物技术产品及生物制品生产的细胞基质的来源和鉴定
Q5DDerivationandCharacterisationofCellSubstratesUsedforProductionofBiotechnological/BiologicalProducts
1997-07-16
2021/11/07
M9
基于生物药剂学分类系统的生物豁免
M9BiopharmaceuticsClassificationSystem-basedBiowaivers
2019-11-20
2021/11/07
M9问答
M9Q&AsQ&AsonBiopharmaceuticsClassificationSystem-basedBiowaivers
2019-11-20
2021/11/07

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
E18
基因组样品采集和基因组数据管理指南
E18GenomicSamplingandManagementofGenomicData
2017-09-06
2022/05/03
M3(R2)
药物进行人体临床试验和上市许可申请的非临床安全性研究指导原则
M3(R2)GuidanceonNonclinicalSafetyStudiesfortheConductofHumanClinicalTrialsandMarketingAuthorizationforPharmaceuticals
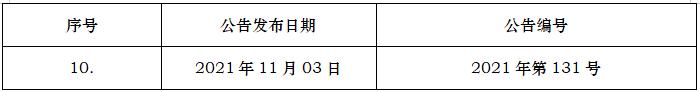
2009-06-11
2021/11/03
M3(R2)问答(R2)
M3的问与答
M3(R2)Q&As(R2)Questions&Answers:GuidanceonNonclinicalSafetyStudiesfortheConductofHumanClinicalTrialsandMarketingAuthorizationforPharmaceuticals
2011-06-15
2021/11/03
ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
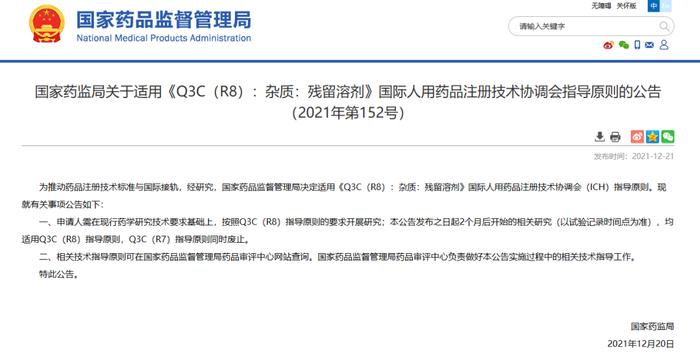
Q3C(R8)
杂质:残留溶剂的指导原则
Q3C(R8)GuidelineforResidualSolvents
2021-04-22
2022/02/21

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
E8(R1)
临床试验的一般考虑
E8(R1) GeneralConsiderationsforClinicalStudies
2021-10-06
2023/07/31
E14
非抗心律失常药物致QT/QTc间期延长及潜在致心里失常作用的临床评价
E14TheClinicalEvaluationofQT/QTcIntervalProlongationandProarrhythmicPotentialforNon-AntiarrhythmicDrugs
2005-05-12
2023/07/31

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
Q3D(R2)
元素杂质指导原则
Q3D(R2)GuidelineforElementalImpurities
2022-04-26
2023/07/29
M10
生物样品分析的方法验证
M10EWGBioanalyticalMethodValidationandStudySampleAnalysis
2022-05-24
2023/07/29

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
S1B(R1)
药物致癌性试验
S1B(R1):TESTINGFORCARCINOGENICITYOFPHARMACEUTICALS
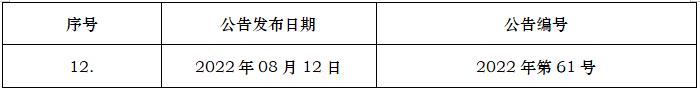
2022/8/4
2023/03/22
E14/S7B问答
QT/QTc间期延长及潜在致心律失常作用的临床和非临床评价问答
E14/S7B:ClinicalandNonclinicalEvaluationofQT/QTcIntervalProlongationandProarrhythmicPotentialQuestionsandAnswers
2022-02-21
2023/07/31

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
E19
在特定的上市前后期或上市后临床试验中选择性收集安全性数据
E19ASelectiveApproachtoSafetyDataCollectioninSpecificLate-StagePre-approvalorPost-ApprovalClinicalTrials
2022-09-27
2023/10/21
ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
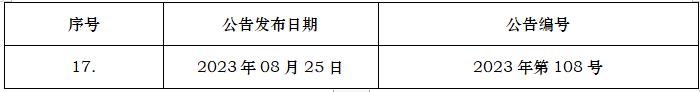
M10问答
M10Q&AsQuestionsandAnswers:BioanalyticalMethodValidationandStudySampleAnalysis
2022-11-16
2023/07/29
ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
Q12
药品生命周期管理的技术和监管考虑
Q12TechnicalandRegulatoryConsiderationsforPharmaceuticalProductLifecycleManagement
2019-11-20
2023/08/25
Q12附件
药品生命周期管理的技术和监管考虑
Q12AnnexesTechnicalandRegulatoryConsiderationsforPharmaceuticalProductLifecycleManagement
2019-11-20
2023/08/25

ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
Q9(R1)
质量风险管理
Q9(R1)QualityRiskManagement
2023-01-18
2024/03/04
ICH编号
中文名称
英文名称
ICH指导原则生效日期
在中国适用开始时间
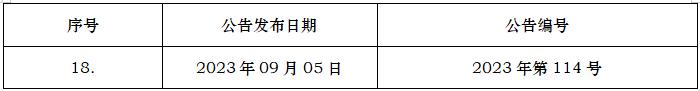
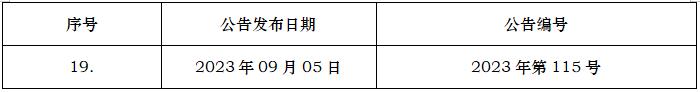
S12
基因治疗产品非临床生物分布的考虑
S12NonclinicalBiodistributionConsiderationsforGeneTherapyProducts
2023-03-14
2023/09/05
20未单独发文,在中国适用的指导原则。
指导原则名称(英文)
指导原则名称(中文)
实施时间点
国家局发布的公告
Q1E:EvaluationforStabilityData
Q1E:稳定性数据的评价
2015-02-05
国家食品药品监督管理总局关于发布普通口服固体制剂溶出度实验技术指导原则和化学药物(原料药和制剂)稳定性研究技术指导原则的通告(2015年第3号)
Q1A(R2):StabilityTestingofNewDrugSubstancesandProducts
Q1A(R2):新原料药和制剂的稳定性试验
2015-02-05
国家食品药品监督管理总局关于发布普通口服固体制剂溶出度实验技术指导原则和化学药物(原料药和制剂)稳定性研究技术指导原则的通告(2015年第3号)
Q1D:BracketingandMatrixingDesignsforStabilityTestingofNewDrugSubstancesandProducts
Q1D:新原料药和制剂稳定性试验的括号法和矩阵法设计
2015-02-05
国家食品药品监督管理总局关于发布普通口服固体制剂溶出度实验技术指导原则和化学药物(原料药和制剂)稳定性研究技术指导原则的通告(2015年第3号)
Q1C:StabilityTestingforNewDosageForms
Q1C:新剂型的稳定性试验
2015-02-05
国家食品药品监督管理总局关于发布普通口服固体制剂溶出度实验技术指导原则和化学药物(原料药和制剂)稳定性研究技术指导原则的通告(2015年第3号)
Q1B:StabilityTesting:PhotostabilityTestingofNewDrugSubstancesandProducts
Q1B:稳定性试验:新原料药和制剂的光稳定性试验
2015-02-05
国家食品药品监督管理总局关于发布普通口服固体制剂溶出度实验技术指导原则和化学药物(原料药和制剂)稳定性研究技术指导原则的通告(2015年第3号)
E6(R2):GoodClinicalPractice(GCP)
E6(R2):药物临床试验质量管理规范
2020-07-01
国家药监局国家卫生健康委关于发布药物临床试验质量管理规范的公告(2020年第57号)
M8:ElectronicCommonTechnicalDocument
M8:电子通用技术文档(eCTD)
2021-12-29
国家药监局关于实施药品电子通用技术文档申报的公告(2021年第119号)
参考文献
[1]www.cde.org.cn
