独家原创 | 康春生教授:外泌体在胶质瘤治疗中的研究进展
转自:药学进展

康春生

教授,博士生导师,天津医科大学总医院神经病学研究所副所长,神经肿瘤实验室主任,兼任中国医师协会胶质瘤专业委员会副主任委员兼基础与转化学组组长,中国神经科学学会神经肿瘤专业委员会副主任委员,中国抗癌学会胶质瘤专业委员会全国常委。2008年入选教育部新世纪人才计划并获得天津市青年科技奖,2014-2018年入选天津市特聘教授,2019年入选国家百千万人才工程并被授予“有突出贡献中青年专家”荣誉称号,2020年被授予国务院特殊津贴专家,2014年开始任NeuroOncol杂志编辑。自2010年至今,累计获得科技部、教育部和国家自然科学基金委员会资助10余项研究计划,研究方向包括纳米医学、肿瘤分子分型、信号通路和小分子药物研发等。以通信作者在AdvMater、NatComm、NeuroOncol、ClinCancerRes、PNAS等高水平杂志发表研究论文150余篇,累计获得3项省部级科技进步一等奖和1项国家科技进步二等奖。国家授权发明专利10项。
外泌体在胶质瘤治疗中的研究进展 PPS
伊凯凯1,2,战琦3,王晓光1,2,康春生3*
(1.天津医科大学肿瘤医院脑系肿瘤科,天津300060;2.国家肿瘤临床医学研究中心天津市肿瘤防治重点实验室天津市恶性肿瘤临床医学研究中心,天津300060;3.天津医科大学总医院天津市神经病学研究所,天津300052)
[摘要]胶质瘤是最常见的原发恶性脑肿瘤。传统化疗药物对胶质瘤靶向性差,且血脑屏障穿透性低,因而在胶质瘤治疗中的应用受到限制。外泌体作为新一代的递药载体,具有良好的生物相容性、稳定性和血脑屏障穿透性,近年来被广泛应用于脑部疾病的靶向递药研究,成果斐然。介绍了外泌体的结构和生物学特性,并对外泌体作为药物递送载体的脑靶向递送策略以及外泌体在胶质瘤治疗中的研究进展进行综述。
胶质瘤是最常见的原发性恶性脑肿瘤,其中胶质母细胞瘤恶性程度最高,具有高侵袭性、高复发率和高死亡率等特性。尽管有手术、放疗和化疗的综合标准性治疗方案,患者的中位生存期仅为14个月。外泌体是纳米级尺寸的细胞外囊泡,可携带多种生物活性分子(如核酸和蛋白质),并通过多种机制在细胞间传递和转移[1-2]。外泌体介导信号转导,在细胞间通讯中发挥重要作用,从而参与许多生理和病理过程[3]。越来越多的证据表明,外泌体在胶质瘤中具有重要作用。胶质瘤来源外泌体可携带其母细胞的生物遗传物质,跨越血脑屏障进入血液循环,可作为胶质瘤诊断的肿瘤标志物。作为物质交换的信使,外泌体可作为药物递送载体用于胶质瘤靶向治疗。基于以上理论,研究人员近年来围绕外泌体作为药物载体在胶质瘤治疗中的应用进行了诸多探索,也验证了外泌体在胶质瘤治疗中的重要作用。现就外泌体作为药物递送载体及其在胶质瘤治疗中的研究进展综述如下。
1
外泌体特性及生物功能
1.1外泌体的来源及产生
外泌体是直径为40~200nm的细胞膜衍生囊泡,在几乎所有类型的细胞(如间充质干细胞、肿瘤细胞,以及树突细胞、巨噬细胞、T细胞等免疫细胞)培养液和各类生物体液(如血液、尿液、牛奶等)中均可分离得到。外泌体具有脂质双分子层膜围绕水性核心的基本结构,其膜上含有多种脂质组分(甘油磷脂、鞘磷脂和胆固醇等)以及多种参与细胞基本生物过程(如细胞黏附、膜融合和信号转导等)的功能蛋白,而水性核心中含有包括microRNA(miRNA)、mRNA、DNA和其他非编码RNA在内的多种核酸[1]。
外泌体的产生可分为4个步骤:1)内吞并形成早期内体;2)内体膜向内出芽形成腔内囊泡;3)形成多泡体(MVB)或晚期内体;4)外泌体从细胞中释放。具体而言,首先内吞作用导致早期内体在细胞内形成,然后通过膜的进一步向内出芽在内体的腔内积累,形成一个多泡体,最终成为晚期内体。这种转变伴随着“货物分拣”过程,即招募各种分子成分(如膜蛋白和RNA等),产生具有特定成分的外泌体[4]。不同的MVB具有不同命运,它们可与溶酶体融合,导致内部囊泡结构和内含物的降解,或与母体细胞的质膜融合,以外分泌方式释放到细胞外[5]。
1.2外泌体的生物功能
外泌体在体液中循环,并将其所携带的生物活性分子转移到受体细胞中[6]。最初,人们认为外泌体的释放是一种清除生物体蛋白质的机制,后来证明外泌体可参与细胞间的交流和不同的生理病理过程[7]。外泌体介导的细胞间通讯可能是单向的也可能是相互的,甚至通过全身循环,外泌体可被输送到各种组织和器官中[8]。目前,文献已报道了外泌体在免疫反应和抗原递呈、疾病发展和机体恢复、血管生成、凝血、细胞和组织的发育与分化中的作用[9-10]。研究表明外泌体针对受体细胞不仅可传递蛋白质和脂质分子以触发下游信号,而且还能传递特定的核酸分子[11]。外泌体与细胞的结合过程通常始于识别受体细胞膜上的特定分子,进而激活该类分子并导致相关信号通路的激活。外泌体可与受体细胞膜融合,随后通过内吞作用使其所携带的蛋白和RNA释放到受体细胞中[12]。此外,外泌体的表面配体不同也可导致其结合过程不同。例如,细胞间黏附分子-1通过与淋巴细胞功能相关抗原的结合,增强了受体细胞对外泌体的捕获[13]。
外泌体的另一临床用途是能够进行液体活检以分析疾病的发展。液体活检可以成为传统活检的理想替代品,因为它的创伤性更小,从而减少了病人的痛苦和不便,并有可能使肿瘤的进展得到比以往更频繁的监测。由于外泌体携带母代细胞的遗传物质,并随全身循环系统进入各类体液中,因此基于其特定的核酸和蛋白,外泌体可被用于疾病的诊断和预后[14]。外泌体在体液中的高丰度也有助于它们在液体活检中作为生物标志物使用。在胶质瘤中,聚合酶1和转录释放因子(PTRF)表达水平与胶质瘤WHO级别呈正相关,与胶质瘤患者预后不良相关。PTRF可以促进胶质瘤细胞外泌体分泌,并通过细胞间信号传递促进受体细胞的增殖。更具临床意义的是,胶质瘤患者术后的血液外泌体中PTRF表达水平比术前外泌体表达下降,提示PTRF可以作为术后复查和判断肿瘤级别的标志物[14]。
总之,外泌体具有多种生物来源。从作为药物载体角度考虑,血液是优选的外泌体来源,因为其中含有丰富的外泌体,且常规、安全的输血证明了同种异源的血液外泌体具有高生物相容性和低免疫原性。此外,从结构特性和生物功能的角度来看,作为一种天然的细胞间生物活性分子传递工具,外泌体具有强大的携带能力、潜在的靶向性和跨越生理屏障的能力,其均为外泌体作为药物递送载体的优势。
2
外泌体作为药物递送载体的研究
外泌体最初被视为细胞的“垃圾”,近年来逐步被发现可作为细胞间的信使,以及可作为诊断性生物标志物来揭示多种疾病的发展过程。随着对外泌体结构特性和生物学功能的了解,越来越多的研究人员在外泌体的结构、组成和生物医学特性的基础上提出了基于外泌体的纳米药物载体的设想。自2011年牛津大学Alvarez-Erviti等[15]首次利用外泌体将外源性siRNA特异性递送至大脑神经元以治疗阿尔茨海默病以来,外泌体已被广泛探索作为小分子药物、核酸、蛋白质和纳米粒子等一系列治疗性分子的递送载体,其中部分制剂已在临床试验中获得积极效果,并向商品化推进。
2.1核酸类药物载体
利用DNA质粒对受体细胞进行靶向递送在基因编辑[如基于成簇的规律间隔的短回文重复序列(clusteredregularlyinterspacedshortpalindromicrepeats,CRISPR)/CRISPR相关蛋白9(Cas9,也称Cas9核酸酶)系统的基因编辑]治疗策略中具有极大的应用潜力,外泌体正在被开发用于质粒递送以及基因编辑治疗。Lin等[16]通过杂交外泌体递送CRISPR/Cas9质粒,在间充质干细胞中实现了高效的体内基因编辑。Gee等[17]利用外泌体开发了一体化的CRISPR/Cas9核糖核蛋白递送平台,在各种难以转染的细胞,包括人类诱导多能干细胞、神经元和肌细胞中均实现了高效的基因编辑。Kim等[18]利用肿瘤细胞来源的外泌体有效地递送CRISPR/Cas9质粒,以靶向抑制多腺苷二磷酸核糖聚合酶1(PARP-1),从而诱导卵巢癌细胞凋亡,并增强其对顺铂的敏感性。
RNA的靶向递送为基因治疗带来了希望。其与靶点结合,即可纠正异常基因或弥补基因缺陷,从基因层面发挥强大的治疗作用。然而,RNA存在细胞摄取率低、药代动力学性质不理想、脱靶性及稳定性低等问题。外泌体天然携带多类型RNA分子的特性,提示可将其开发为RNA递送载体。AlvarezErviti等[15]首次通过注射外泌体将siRNA递送到小鼠大脑中,他们以树突状细胞作为供体细胞,将神经元特异性靶向肽RVG肽与外泌体膜蛋白Lamp2b融合,使分泌的外泌体具有神经元靶向能力,进而递送siRNA,将特定的基因敲除,以治疗阿尔茨海默病。受到这项工作的启发,Kamerkar等[19]对源自正常成纤维细胞样间充质细胞的外泌体进行改造,使其携带可特异性靶向胰腺癌G12D突变KRAS基因的siRNA或shRNA。与脂质体相比,这种工程化外泌体针对KRAS基因的疗效增强,可在多种胰腺癌小鼠模型中实现肿瘤抑制,并显著提高动物总生存率。该研究小组已与美国Codiak公司合作,进行该治疗策略的Ⅰ期临床试验[20]。
2.2小分子药物载体
传统小分子药物存在水溶性差、稳定性不佳和缺乏靶向性的问题,需要以合适载体递送,以提高药物体内稳定性与在病灶部位的浓度,并降低毒副作用。脂质体及一些合成纳米载体最早被用于小分子药物递送,但合成材料的复杂性限制了该类药物载体的大规模生产和临床转化。外泌体具有与脂质体相似的结构,即磷脂双分子层围绕亲水性核心,为亲水性和疏水性药物提供了负载位点,同时外泌体含有多种天然的膜蛋白,使其作为药物载体的功能化设计程序得以简化,因而具有开发为小分子药物递送载体的潜力。
2010年,Sun等[21]首次将姜黄素封装在外泌体中,发现姜黄素的抗炎活性得到了增强,有关构建基于外泌体的小分子药物递送载体的研究也就此开始。Tian等[22]将阿霉素(DOX)负载到外泌体中用于肿瘤治疗。Hadla等[23]的研究表明,肿瘤细胞衍生外泌体装载DOX,可使心脏中的DOX减少约40%,并增加肿瘤中DOX含量,从而达到肿瘤抑制效果。外泌体介导的递送提高了DOX的循环稳定性,并促进了DOX在肿瘤细胞中的富集。除DOX外,外泌体对紫杉醇(PTX)也可实现有效的负载,在肺癌模型中展现出优异的抗肿瘤效果[24]。Agrawal等[25]使用牛奶来源外泌体封装PTX,并证明口服负载PTX的外泌体可以有效地抑制肿瘤生长。Sancho-Albero等[26]将钯(Pd)催化剂载入肿瘤细胞衍生的外泌体中,负载Pd催化剂的外泌体显示出对亲代细胞的优先趋向性,提示外泌体介导的催化剂递送或可为肿瘤靶向治疗提供新的方向。外泌体作为小分子药物递送系统已被广泛探索,但大部分研究仍处于起步阶段,一些问题亟待解决,例如如何进一步提高外泌体及其负载药物在病灶部位的浓度。
外泌体不仅可单独作为小分子药物载体,还可将小分子药物疗法与其他疗法相结合,以优化治疗效果。外泌体天然地具有脂质双层围绕亲水性核心的结构,为RNA和小分子药物提供了负载位点。Zhan等[27]通过疏水锚定、构建超顺磁性纳米团簇和静电作用对外泌体的脂质双分子层及膜蛋白进行改造,构建了集“RNA/药物共载”、“肿瘤靶向”和“内涵体逃逸”这3种功能于一身的血液外泌体药物递送体系,并通过体内和体外实验初步证实了该纳米载体的成功构建。构建步骤如下:先将偶联了转铁蛋白配体的超顺磁性纳米颗粒与血液外泌体表面的转铁蛋白受体结合,构建基于外泌体的超顺磁性纳米团簇;利用外泌体的脂质双分子层结构,通过疏水锚定作用,将疏水性药物DOX和胆固醇修饰的反义miRNA21分子共载到外泌体中;将一种阳离子型的内涵体裂解肽L17E静电吸附到外泌体膜表面。
2.3蛋白类药物载体
蛋白质在生命活动中具有独特作用,与蛋白相关的疗法引起了广泛关注。研究人员尝试将外泌体用于递送外源性治疗蛋白,例如Haney等[28]开发了基于外泌体的过氧化氢酶递送系统,将其用于帕金森病的治疗。Yuan等[29]报道,巨噬细胞衍生的外泌体能够递送脑源性神经营养因子,实现治疗性蛋白的有效脑内递送。外泌体在膜表面和内部均含有多种蛋白,尽管其中的大多蛋白与受体细胞相似,可能治疗作用较小,但这些生物大分子可提供结合位点,与受体细胞表面的特定配体结合,从而有利于外泌体靶向受体细胞;或与外源性治疗蛋白结合,从而进行有效的蛋白递送。Li等[30]利用外泌体膜上的糖基磷脂酰肌醇锚定PH20透明质酸酶,进而催化透明质酸的降解,以增强药物对肿瘤的穿透性以及在肿瘤组织中的扩散。Yim等[31]提出了细胞内递送目标蛋白的新概念,并设计了HEK293T细胞衍生的外泌体,将其用于细胞内光学响应蛋白的递送。基于外泌体的蛋白递送研究结果提示,可以充分利用外泌体表面多样的膜蛋白进行治疗剂负载以及靶向递送的工程化设计。
3
外泌体的脑靶向递送策略
血脑屏障限制了许多药物在脑部疾病治疗中的应用。外泌体因其良好的生物相容性、稳定性和血脑屏障穿透性等优点,具有开发为跨血脑屏障递送载体的巨大潜力。外泌体可通过以下途径实现血脑屏障的渗透:1)受体介导的转胞吞作用;2)细胞表面黏附融合;3)巨胞饮作用;4)脂筏介导转运。目前,几种天然的脑靶向外泌体和多肽功能化外泌体已被广泛用于探索脑部疾病的治疗。本章节对几类常用的外泌体脑靶向递送策略进行简要介绍。
3.1使用天然具有脑靶向作用的外泌体
天然外泌体具有的生物学功能使得其可黏附于细胞或被不同的细胞捕获,这些机制还可促使外泌体在血脑屏障中的渗透。研究显示,某些来源外泌体可以跨越血脑屏障,例如Yuan等[29]的研究表明,天然巨噬细胞外泌体可以穿过血脑屏障,主要机制是外泌体上的淋巴细胞功能相关抗原(LFA)-1和血脑屏障中的细胞间黏附分子(ICAM)-1以及脑微血管内皮细胞bEnd.3上的C型凝集素受体间存在相互作用。Chen等[32]的研究表明,外泌体在肿瘤坏死因子(TNF)-α激活下可通过转胞吞作用穿过脑微血管内皮细胞单层。上述研究提示,某些特定细胞的外泌体为脑靶向药物递送提供了一个潜在的途径。
3.2脑归巢肽修饰策略
研究人员尝试在外泌体表面进行各种修饰,以实现外泌体的脑靶向递送,其中最早使用的修饰分子是细胞靶向肽。该领域研究由Alvarez-Erviti等[15]开始,课题组通过设计,用树突细胞表达Lamp2b和RVG肽的融合蛋白,从而产生可靶向大脑神经元的外泌体。Hung等[33]使用类似的方法,以胶质瘤细胞靶向肽修饰外泌体,增强了外泌体向胶质瘤细胞的脑靶向递送。这类策略通过增强外泌体与病灶细胞的结合来实现脑靶向递送,但未考虑血脑屏障的阻碍。
3.3基于受体介导转运的修饰策略
受体介导转运(RMT)是跨血脑屏障递送物质的常用策略,也被用于外泌体的表面修饰。在血脑屏障中普遍表达的受体有转铁蛋白(Tf)受体(TfR)、低密度脂蛋白受体(LDLR)、胰岛素受体(INSR)等。Kim等[34]使用T7肽(一种TfR结合肽)与Lamp2b的融合基因转染供体细胞,以产生修饰有T7肽的外泌体T7-EXO,发现T7-EXO比RVG肽标记的外泌体具有更高的脑靶向效率。Choi等[35]开发了负载甲氨蝶呤、且修饰了促凋亡多肽和靶向LDLR的多肽的外泌体,其可穿透血脑屏障并促进药物在脑肿瘤部位积累。以上研究证实了利用受体介导的血脑屏障转运机制对外泌体进行修饰以增强其脑靶向作用的可行性。
4
外泌体在胶质瘤治疗中的研究
多项研究表明,一些细胞来源的外泌体因天然地携带某些具有生物活性的RNA和蛋白分子,本身就具有一定的肿瘤治疗潜力。例如,自然杀伤细胞(NK细胞)免疫疗法是一种低毒性的可替代化疗和放疗的方法,NK细胞来源的外泌体可靶向胶质瘤细胞并发挥抗肿瘤作用,然而其确切机制尚不清楚[36]。
此外,外泌体作为纳米级的药物递送载体,也是最有希望实现肿瘤精准治疗的工具之一。外泌体载药策略可分为内源装载和外源装载两大类。内源装载指的是将RNA、蛋白及其他小分子药物先在产生外泌体的细胞中进行装载,而外源装载指的是先提取与纯化外泌体,再完成药物分子的装载过程。需强调的是,提高外泌体的负载能力对于增强抗肿瘤药物向胶质瘤的递送并在肿瘤组织中保持适当的药物浓度至关重要。
在外泌体内源装载方面,多项研究证明可通过生物学方法对细胞进行改造,使其分泌的外泌体中包含目的分子。miRNA可以影响胶质瘤细胞的化疗耐药和药物外排等过程,通过靶向特定基因,miRNA可作为肿瘤抑制因子发挥作用。转染抗肿瘤miRNA的间充质干细胞所衍生的外泌体已显示出治疗胶质瘤的潜力。Hao等[37]研究发现,人脐带间充质干细胞衍生的外泌体可通过调控miR-10a-5p/PTEN信号通路发挥部分抗肿瘤活性。Monfared等[38]研究表明,携有miR-21的外泌体可减小胶质瘤模型小鼠的肿瘤体积。Munoz等[39]利用间充质干细胞衍生的外泌体将anti-miR-9递送到胶质瘤中,发现肿瘤对替莫唑胺的化疗敏感性增加。
有关外泌体外源装载方面的研究,也有许多文献报道。Jia等[40]首次将超顺磁性氧化铁纳米颗粒(SPION)和姜黄素(Cur)加载到外泌体中,并通过点击化学反应将外泌体膜与neuropilin-1靶向肽结合,得到具有成像和治疗功能的靶向胶质瘤的外泌体。在体内和体外实验中,课题组观察到这些被修饰的外泌体可顺利穿过血脑屏障并积聚在肿瘤组织,同时也显示了显著的抗肿瘤效果。Zhan等[41]提取了血液外泌体,对外泌体进行工程化设计,构建了可负载细胞质磷脂酶(cPLA2)siRNA(sicPLA2)和二甲双胍(Met)的外泌体递药系统Exos-Met/sicPLA2,该治疗策略可抑制胶质瘤的线粒体能量代谢。在胶质瘤患者来源肿瘤异种移植模型(PDX)中,Exos-Met/sicPLA2的全身给药表现出有效的血脑屏障渗透以及在胶质瘤中的特异性积累,抑制了肿瘤增殖并延长了模型动物的存活时间(见图1)。
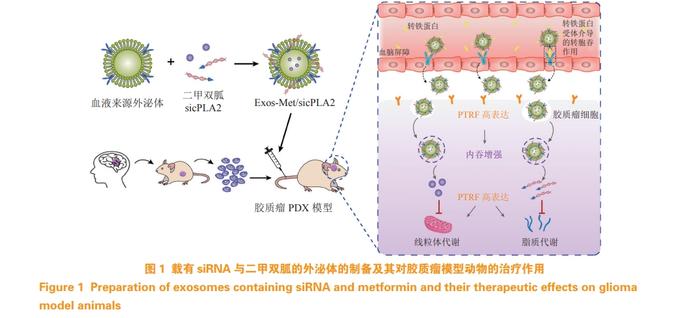
Yang等[42]在脑微血管内皮细胞bEnd.3衍生的外泌体中负载PTX和阿霉素,在用胶质瘤细胞构建的斑马鱼脑肿瘤模型中证实了该外泌体递药系统的血脑屏障穿透性。研究表明,bEnd.3细胞衍生的外泌体可以有效地使其负载的PTX和阿霉素跨越血脑屏障,传递到肿瘤部位,从而提高药物对胶质瘤细胞的杀伤效果。Erkan等[43]基于基因工程技术构建了携有尿嘧啶磷酸核糖基转移酶的外泌体,其可将5-氟胞嘧啶转化为5-氟尿嘧啶,从而发挥胶质瘤治疗作用。
近年来,聚焦超声技术也被应用于外泌体药物递送中,其可使载药外泌体穿透血脑屏障,有效增加肿瘤组织内的药物浓度。Bai等[44]在血清来源的外泌体上标记荧光分子,并构建了可治疗胶质瘤的外泌体给药系统。该课题组比较了外泌体给药联合聚焦超声技术与单独使用外泌体给药的递送效果,体内动物成像研究表明,接受单次颅内聚焦超声的动物其脑组织外泌体荧光强度相比于未接受聚焦超声的动物增加了4.45倍。同时,血清来源外泌体联合颅内聚焦超声治疗可促进肿瘤部位药物富集,更有效地抑制了胶质瘤的生长。上述研究结果提示,聚焦超声可提高血清来源外泌体的血脑屏障穿透性,从而增强其负载药物对脑肿瘤的疗效。
5
结语与展望
在过去十年中,外泌体因其低免疫原性和良好的生物相容性被认为是一种极具开发前景的药物递送载体。近来,越来越多研究人员尝试使用基因工程和化学方法对外泌体进行工程化改造,以实现药物的靶向递送。胶质瘤作为难治性肿瘤之一,其药物治疗难度大,主要原因是血脑屏障严重限制了化疗药物对病灶部位的渗透和积累。而基于外泌体的药物递送系统可携带药物分子穿透血脑屏障,增加胶质瘤病灶部位的药物蓄积,还可通过与其他治疗手段(如前文介绍的聚焦超声技术)联用发挥协同作用。因此,基于脑靶向外泌体的药物递送系统在克服胶质瘤治疗瓶颈方面具有巨大的开发潜力。本文综述了基于外泌体的药物递送系统在胶质瘤治疗中的应用研究进展,旨在为胶质瘤治疗策略的开发提供思路与参考。笔者认为,从胶质瘤特征出发,利用生物材料方法对外泌体进行工程化设计,建立和完善药物递送的技术平台,将是胶质瘤研究领域未来的重要方向之一。需强调的是,基于脑靶向外泌体的给药系统在其开发过程中还面临着一系列问题和挑战,例如外泌体的大规模生产仍然是一个难题,以目前技术水平,难以获得足够的外泌体用于临床治疗;此外,目前缺乏标准的外泌体分离方法和质量控制方案,或影响其临床治疗效果。推进外泌体在胶质瘤治疗中的临床转化任重道远。
参考文献:
[1]KalluriR,LebleuVS.Thebiology,function,andbiomedicalapplicationsofexosomes[J].Science,2020,367(6478):eaau6977.DOI:10.1126/science.aau6977.
[2]MathieuM,Martin-JaularL,LavieuG,etal.Specificitiesofsecretionanduptakeofexosomesandotherextracellularvesiclesforcell-tocellcommunication[J].NatCellBiol,2019,21(1):9-17.
[3]TkachM,TheryC.Communicationbyextracellularvesicles:whereweareandwhereweneedtogo[J].Cell,2016,164(6):1226-1232.
[4]GowdaR,RobertsonBM,IyerS,etal.Theroleofexosomesinmetastasisandprogressionofmelanoma[J].CancerTreatRev,2020,85:101975.DOI:10.1016/j.ctrv.2020.101975.
[5]OstrowskiM,CarmoNB,KrumeichS,etal.Rab27aandRab27bcontroldifferentstepsoftheexosomesecretionpathway[J].NatCellBiol,2010,12(1):19-30.
[6]LinS,YuZ,ChenD,etal.Progressinmicrofluidics-basedexosomeseparationanddetectiontechnologiesfordiagnosticapplications[J].Small,2020,16(9):e1903916.DOI:10.1002/smll.201903916.
[7]ÖzdemirS.IdentificationandcomparisonofexosomalmicroRNAsinthemilkandcolostrumoftwodifferentcowbreeds[J].Gene,2020,743:144609.DOI:10.1016/j.gene.2020.144609.
[8]HerrmannIK,WoodMJA,FuhrmannG.Extracellularvesiclesasanext-generationdrugdeliveryplatform[J].NatNanotechnol,2021,16(7):748-759.
[9]WangX,LuoG,ZhangK,etal.Hypoxictumor-derivedexosomalmiR-301amediatesM2macrophagepolarizationviaPTEN/PI3Kgammatopromotepancreaticcancermetastasis[J].CancerRes,2018,78(16):4586-4598.
[10]YiM,XuL,JiaoY,etal.Theroleofcancer-derivedmicroRNAsincancerimmuneescape[J].JHematolOncol,2020,13(1):25.DOI:10.1186/s13045-020-00848-8.
[11]LiuY,GuY,HanY,etal.TumorexosomalRNAspromotelungpremetastaticnicheformationbyactivatingalveolarepithelialTLR3torecruitneutrophils[J].CancerCell,2016,30(2):243-256.
[12]TheryC,OstrowskiM,SeguraE.Membranevesiclesasconveyorsofimmuneresponses[J].NatRevImmunol,2009,9(8):581-593.
[13]SeguraE,NiccoC,LombardB,etal.ICAM-1onexosomesfrommaturedendriticcellsiscriticalforefficientnaiveT-cellpriming[J].Blood,2005,106(1):216-223.
[14]HuangK,FangC,YiK,etal.TheroleofPTRF/Cavin1asabiomarkerinbothgliomaandserumexosomes[J].Theranostics,2018,8(6):1540-1557.
[15]Alvarez-ErvitiL,SeowY,YinH,etal.DeliveryofsiRNAtothemousebrainbysystemicinjectionoftargetedexosomes[J].NatBiotechnol,2011,29(4):341-345.
[16]LinY,WuJ,GuW,etal.Exosome-liposomehybridnanoparticlesdeliverCRISPR/Cas9systeminMSCs[J].AdvSci(Weinh),2018,5(4):1700611.DOI:10.1002/advs.201700611.
[17]GeeP,LungMSY,OkuzakiY,etal.ExtracellularnanovesiclesforpackagingofCRISPR-Cas9proteinandsgRNAtoinducetherapeuticexonskipping[J].NatCommun,2020,11(1):1334.DOI:10.1038/s41467-020-14957-y.
[18]KimSM,YangY,OhSJ,etal.Cancer-derivedexosomesasadeliveryplatformofCRISPR/Cas9confercancercelltropismdependenttargeting[J].JControlRelease,2017,266:8-16.
[19]KamerkarS,LebleuVS,SugimotoH,etal.ExosomesfacilitatetherapeutictargetingofoncogenicKRASinpancreaticcancer[J].Nature,2017,546(7659):498-503.
[20]MendtM,KamerkarS,SugimotoH,etal.Generationandtestingofclinical-gradeexosomesforpancreaticcancer[J].JCIInsight,2018,3(8):e99263.DOI:10.1172/jci.insight.99263.
[21]SunD,ZhuangX,XiangX,etal.Anovelnanoparticledrugdeliverysystem:theanti-inflammatoryactivityofcurcuminisenhancedwhenencapsulatedinexosomes[J].MolTher,2010,18(9):1606-1614.
[22]TianY,LiS,SongJ,etal.Adoxorubicindeliveryplatformusingengineerednaturalmembranevesicleexosomesfortargetedtumortherapy[J].Biomaterials,2014,35(7):2383-2390.
[23]HadlaM,PalazzoloS,CoronaG,etal.Exosomesincreasethetherapeuticindexofdoxorubicininbreastandovariancancermousemodels[J].Nanomedicine(Lond),2016,11(18):2431-2441.
[24]KimMS,HaneyMJ,ZhaoY,etal.Engineeringmacrophagederivedexosomesfortargetedpaclitaxeldeliverytopulmonarymetastases:invitroandinvivoevaluations[J].Nanomedicine,2018,14(1):195-204.
[25]AgrawalAK,AqilF,JeyabalanJ,etal.Milk-derivedexosomesfororaldeliveryofpaclitaxel[J].Nanomedicine,2017,13(5):1627-1636.
[26]Sancho-AlberoM,Rubio-RuizB,Perez-LopezAM,etal.Cancerderivedexosomesloadedwithultrathinpalladiumnanosheetsfortargetedbioorthogonalcatalysis[J].NatCatal,2019,2(10):864-872.
[27]ZhanQ,YiK,QiH,etal.Engineeringbloodexosomesfortumortargetingefficientgene/chemocombinationtherapy[J].Theranostics,2020,10(17):7889-7905.
[28]HaneyMJ,KlyachkoNL,ZhaoY,etal.ExosomesasdrugdeliveryvehiclesforParkinson'sdiseasetherapy[J].JControlRelease,2015,207:18-30.
[29]YuanD,ZhaoY,BanksWA,etal.Macrophageexosomesasnaturalnanocarriersforproteindeliverytoinflamedbrain[J].Biomaterials,2017,142:1-12.
[30]LiL,LuY,JiangC,etal.Activelytargeteddeeptissueimagingandphotothermal-chemotherapyofbreastcancerbyantibodyfunctionalizeddrug-loadedX-ray-responsivebismuthsulfide@mesoporoussilicacore-shellnanoparticles[J].AdvFunctMater,2018,28(5):1704623.DOI:10.1002/adfm.201704623.
[31]YimN,RyuSW,ChoiK,etal.Exosomeengineeringforefficientintracellulardeliveryofsolubleproteinsusingopticallyreversibleprotein-proteininteractionmodule[J].NatCommun,2016,7:12277.DOI:10.1038/ncomms12277.
[32]ChenCC,LiuL,MaF,etal.Elucidationofexosomemigrationacrosstheblood-brainbarriermodelinvitro[J].CellMolBioeng,2016,9(4):509-529.
[33]HungME,LeonardJN.Stabilizationofexosome-targetingpeptidesviaengineeredglycosylation[J].JBiolChem,2015,290(13):8166-8172.
[34]KimG,KimM,LeeY,etal.SystemicdeliveryofmicroRNA-21antisenseoligonucleotidestothebrainusingT7-peptidedecoratedexosomes[J].JControlRelease,2020,317:273-281.
[35]ChoiH,ChoiK,KimDH,etal.Strategiesfortargeteddeliveryofexosomestothebrain:advantagesandchallenges[J].Pharmaceutics,2022,14(3):672.DOI:10.3390/pharmaceutics14030672.
[36]FedericiC,ShahajE,CecchettiS,etal.Natural-killer-derivedextracellularvesicles:immunesensorsandinteractors[J].FrontImmunol,2020,11:262.DOI:10.3389/fimmu.2020.00262.
[37]HaoSC,MaH,NiuZF,etal.hUC-MSCssecretedexosomesinhibitthegliomacellprogressionthroughPTENP1/miR-10a-5p/PTENpathway[J].EurRevMedPharmacolSci,2019,23(22):10013-10023.
[38]MonfaredH,JahangardY,NikkhahM,etal.PotentialtherapeuticeffectsofexosomespackedwithamiR-21-spongeconstructinaratmodelofglioblastoma[J].FrontOncol,2019,9:782.DOI:10.3389/fonc.2019.00782.
[39]MunozJL,BlissSA,GrecoSJ,etal.DeliveryoffunctionalantimiR-9bymesenchymalstemcell-derivedexosomestoglioblastomamultiformecellsconferredchemosensitivity[J].MolTherNucleicAcids,2013,2(10):e126.DOI:10.1038/mtna.2013.60.
[40]JiaG,HanY,AnY,etal.NRP-1targetedandcargo-loadedexosomesfacilitatesimultaneousimagingandtherapyofgliomainvitroandinvivo[J].Biomaterials,2018,178:302-316.
[41]ZhanQ,YiK,CuiX,etal.Bloodexosomes-basedtargeteddeliveryofcPLA2siRNAandmetformintomodulateglioblastomaenergymetabolismfortailoringpersonalizedtherapy[J].NeuroOncol,2022,24(11):1871-1883.
[42]YangT,MartinP,FogartyB,etal.Exosomedeliveredanticancerdrugsacrosstheblood-brainbarrierforbraincancertherapyinDaniorerio[J].PharmRes,2015,32(6):2003-2014.
[43]ErkanEP,SenfterD,MadlenerS,etal.ExtracellularvesiclemediatedsuicidemRNA/proteindeliveryinhibitsglioblastomatumorgrowthinvivo[J].CancerGeneTher,2017,24(1):38-44.
[44]BaiL,LiuY,GuoK,etal.Ultrasoundfacilitatesnaturallyequippedexosomesderivedfrommacrophagesandbloodserumfororthotopicgliomatreatment[J].ACSApplMaterInterfaces,2019,11(16):14576-14587.
