【华西医药崔文亮团队】️《康方生物-B深度报告:双抗龙头药企,迎来商业化收获期》
转自:崔文亮研究团队
【华西医药崔文亮团队】️我们2023年05月30日最新发布详细【43页】️《双抗龙头药企,迎来商业化收获期》
摘要
公司为国内双抗赛道的龙头,多款核心双抗处于已上市或即将上市阶段,其中核心产品卡度尼利(PD-1/CTLA-4双抗)为全球首个获批上市的肿瘤免疫治疗双抗,具有高效低毒优势,在多个适应症中展现出优于现有临床方案的疗效和安全性;公司的另外一款核心产品依沃西是全球首个进入临床阶段的PD-1/VEGF双抗,海外授权交易总金额达50亿美元,刷新业内记录。公司研发管线深厚,多款在研产品覆盖肿瘤、自身免疫病等领域,市场空间广阔且竞争优势明显,作为双抗领域龙头企业,重磅管线快速推进迎来商业化收获期。
首创的双抗产品上市后快速放量,商业化进程迅猛
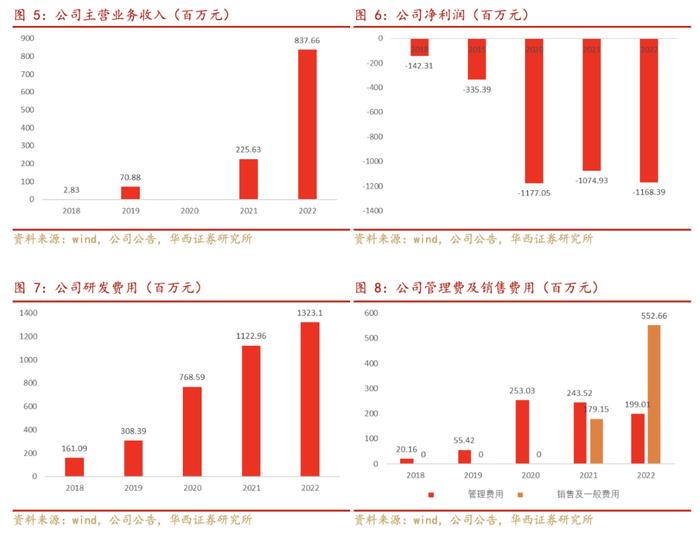
公司2022年度产品市场销售额为11.04亿元,截至2021年12月31日止年度为人民币2.1亿元,同比增长422%,其中新获批准的开坦尼®(卡度尼利单抗)销售开局业绩强劲,产品市场销售额为人民币5.46亿元;安尼可®(派安普利单抗)业绩亦快速增长,截至2022年12月31日止年度产品市场销售额为人民币5.58亿元,去年同期为人民币2.1亿元,同比增长164%。截至2022年12月31日止年度,公司已确认收益人民币8.37亿元,包括来自产品及许可证收入销售额人民币11.08亿元,扣除分销成本人民币2.7亿元。
研发管线布局丰富,预期多个核心产品陆续上市
公司预期多个新药在2023年首次向NMPA递交新药上市申请,包括依沃西治疗EGFR-TKI耐药的EGFR突变NSCLC适应症的首次新药上市申请,自身免疫和代谢疾病领域的依若奇单抗(IL–12/IL–23,AK101)治疗中重度银屑病适应症以及伊努西单抗(PCSK9,AK102)2项治疗高胆固醇血症适应症的首次新药上市申请等。在2023年1月,安尼可®联合化疗一线治疗sq-NSCLC已经获批上市。创新药物销售收入不断突破,进一步夯实公司的药物研发、生产、销售的一体化高效循环体系。
依托一体化平台,建设研发创新关键能力
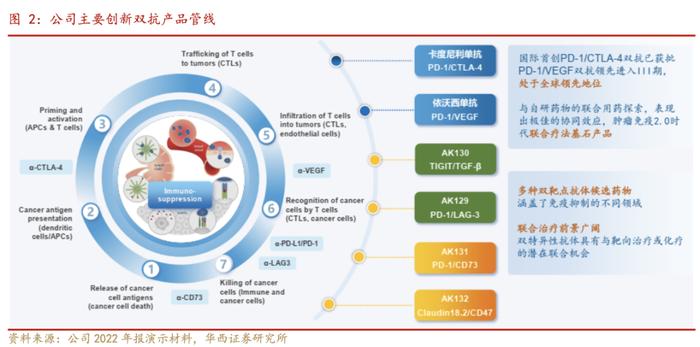
公司依托ACE平台和Tetrabody平台,建立了围绕创新抗体新药的全方位一体化的药物发现和开发功能,涵盖了药品研究、开发、生产、商业化的全生命周期。自主开发了用于设计及生产创新四价双特异性抗体的专有技术(Tetrabody技术)。凭借开发平台与专有技术支持,公司研发了涵盖了肿瘤、自身免疫性疾病、炎症和心血管疾病等领域的多个产品管线,解决了研发双特异性抗体的多个技术难题。基于独有的Tetrabody技术,公司已成功开发了6个全球领先的双特异性抗体药物,包括全球首个获批上市的肿瘤双免疫检查点双抗开坦尼®(PD-1/CTLA-4双抗,卡度尼利单抗注射液),全球首个进入临床III期的PD-1/VEGF双特异抗体新药依沃西(AK112),以及全球首个且唯一在研的TIGIT/TGF-β双靶点抗体融合蛋白新药AK130等,充分体现了公司在双抗领域的创新开发实力和领先地位。
盈利预测与投资建议
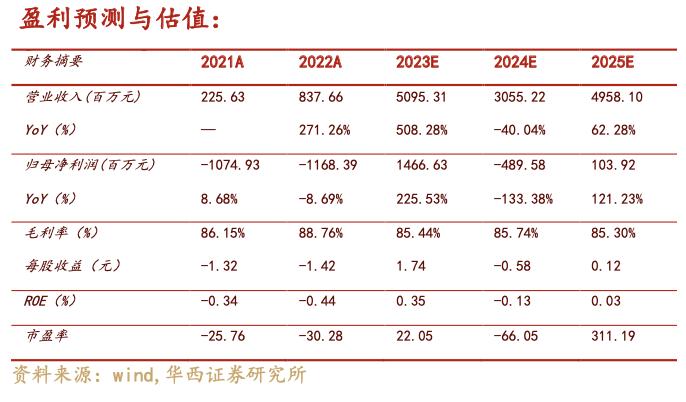
我们预测2023-2025年公司营业总收入为50.95/30.55/49.58亿元,分别同比增长508%/-40%/62%,归母净利润为14.7/-4.9/1.0亿元,EPS分别为1.74/-0.58/0.12元,对应2023年5月23日收盘价38.45港元,PE分别为22/-66/311X。看好公司产品上市后商业化运营能力,产品持续放量,以及后续创新靶点管线持续不断的推陈出新,采用自由现金流DCF折现估值方法,公司估值为411亿元,对应股价48.89元,折合港币56.2元,首次覆盖,给予公司“买入”评级。
风险提示:研发不及预期,市场竞争加剧,技术升级及产品迭代风险;商业化推广不及预期,导致药品销售不及预期风险;海外推进不及预期


正文
1.康方生物:双抗龙头,创新生物制药公司
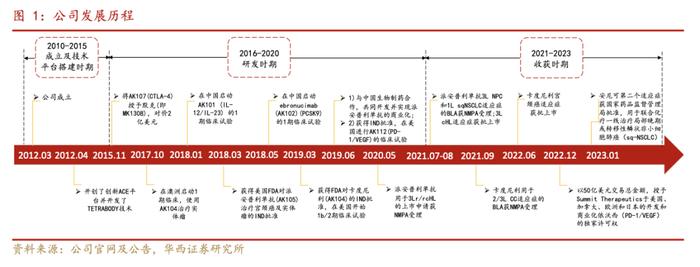
1.1.公司发展历程
康方生物于2012年在广东成立,是一家集研究、开发、生产与一体并致力于商业化全球病人可负担的创新抗体新药的生物制药公司,于2020年4月24日正式在香港联合交易所有限公司主板挂牌上市。其具有端对端全方位的药物开发平台(ACE平台),目前拥有30个以上用于治疗肿瘤、自身免疫、炎症、代谢疾病等重大疾病的创新药物产品管线。其中,核心产品均已进入收获期:开坦尼®(PD-1xCTLA-4)已于2022年6月获批,成为全球第一款PD-1双抗;AK112(PD-1xVEGF)迅速推进肺癌的注册性临床。开坦尼®上市首6个月内,实现了5.46亿元销售额的优异成绩。
2022年12月,依沃西以总交易额高达50亿美元和2位数销售提成的合作方案,授予美国SummitTherapeutics公司在美国、欧洲、加拿大和日本的独家开发和商业化权益,创下中国单个创新药海外授权新记录。2023年,依沃西海外授权合作的等值于5亿美元首付款已经到账。此外,公司拟将于上海证券交易所科创板上市的相关工作也已经启动。公司将持续不断拓展多元化融资渠道,进而全面加速公司核心产品和管线的临床开发和上市进程。
1.2.一体化研究平台,建设研发创新关键能力
公司依托ACE平台和Tetrabody平台,建立了围绕创新抗体新药的全方位一体化的药物发现和开发功能,涵盖了药品研究、开发、生产、商业化的全生命周期。
在自主研发上,公司建立了国际水平的生物制药全程研发及产业化的一体化开发平台(ACE平台),自主开发了用于设计及生产创新四价双特异性抗体的专有技术(Tetrabody技术)。凭借开发平台与专有技术支持,公司研发了涵盖了肿瘤、自身免疫性疾病、炎症和心血管疾病等领域的多个产品管线,解决了研发双特异性抗体的多个技术难题。
目前,基于独有的Tetrabody技术,公司已成功开发了6个全球领先的双特异性抗体药物,包括全球首个获批上市的肿瘤双免疫检查点双抗开坦尼®(PD-1/CTLA-4双抗,卡度尼利单抗注射液),全球首个进入临床III期的PD-1/VEGF双特异抗体新药依沃西(AK112),以及全球首个且唯一在研的TIGIT/TGF-β双靶点抗体融合蛋白新药AK130等,充分体现了公司在双抗领域的创新开发实力和领先地位。
公司与国内外多家制药公司建立了多形式的深度合作关系,研发产品达成多次海外授权:
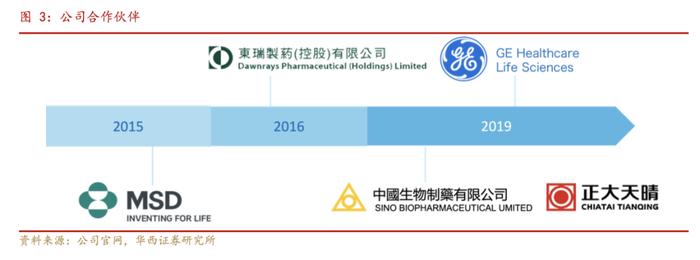
2015年,康方生物将自主研发的肿瘤免疫治疗抗体药物AK107(MK-1308)以2亿美元授权全球前五强制药巨头—美国默沙东。
2019年,公司与正大天晴建立合作关系,共同开发及商业化康方研发的PD-1抗体药物(AK105)(通用名:派安普利;商品名:安尼可)。
2022年,公司创下了中国创新药license-out合作的交易金额记录,以高达50亿美元的交易总金额,授予美国SummitTherapeutics公司于美国、加拿大、欧洲和日本的开发和商业化公司独立自主研发的依沃西(PD-1/VEGF双特异性抗体)的独家许可权。通过与全球顶尖团队的合作,公司创新药物全球化商业化潜力不断显现。
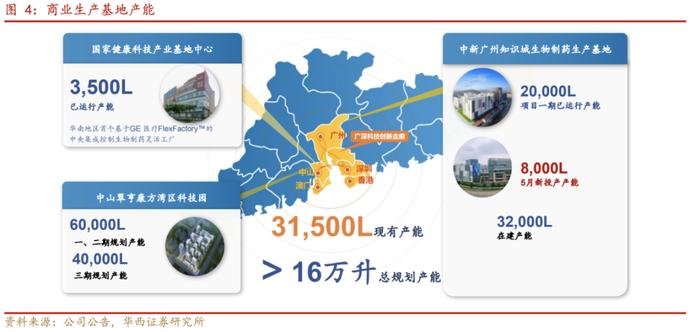
公司在国内多地建立生产基地,具备一体化的先进生产能力。公司优良生产设施体系符合国内外药监机构(NMPA、FDA、EMA)的要求,能够支持从药物发现到药品开发、GMP合规试点到商业化生产的全过程。目前公司在中山、广州等地均有生产布局,规划总产能超过160,000L。
基地建设日益完善,产能逐步释放:位于中山的国家健康科技产业基地园区,拥有GEHealthcareFlexFactory(TM)技术,以及中央控制和一次性生物反应器系统,目前已有产能3500L;中新广州知识城生物制药基地,规划产能达到60000L,配备了GEFF全套原液生产设备、BOSCH全自动制剂灌装生产线等,主要负责核心产品卡度尼利的生产;而位于中山的翠亨康方科技园,总规划产能超过10万升,是集研发、生产、销售于一体,建成后将成为全球技术水平领先的生物医药创新研发和产业化基地。
1.3.产品上市后商业化进程迅猛
公司2022年度产品市场销售额为11.04亿元,截至2021年12月31日止年度为人民币2.1亿元,同比增长422%,其中新获批准的开坦尼®(卡度尼利单抗)销售开局业绩强劲,产品市场销售额为人民币5.46亿元;安尼可®(派安普利单抗)业绩亦快速增长,截至2022年12月31日止年度产品市场销售额为人民币5.58亿元,去年同期为人民币2.1亿元,同比增长164%。截至2022年12月31日止年度,公司已确认收益人民币8.37亿元,包括来自产品及许可费收入销售额人民币11.08亿元,扣除分销成本人民币2.7亿元。
2022年度营业成本为人民币94.1百万元,2021年为人民币31.3百万元,同比增长201%,营业成本的增长主要来自开坦尼®(卡度尼利单抗)及安尼可®(派安普利单抗)销售增长带来的原材料、直接劳动力成本、厂房机器折旧及有关生产费用的增长。2022年度毛利为人民币743.5百万元,同比增长283%,主要归因于收入的大幅增长。2022年度研发开支为人民币1,323.1百万元,同比增长18%,研发开支的增长主要来自于更多的产品推进至后期临床测试阶段。2022年度销售及营销开支为人民币552.7百万元,同比增长209%,营销开支的增长主要是来自于推广新获批的产品开坦尼®(卡度尼利单抗),以及安尼可®(派安普利单抗)的营销活动。
2.研发管线布局丰富:多个核心产品陆续上市
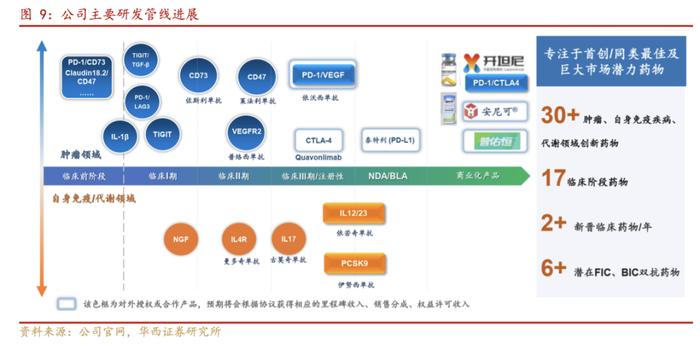
公司首款肿瘤免疫治疗产品,安尼可®(派安普利AK105,PD-1)注射剂于2021年8月在中国获NMPA批准上市,2022年6月29日,公司完全独立自主研发生产的全球首创PD–1/CTLA–4双抗新药开坦尼(®卡度尼利单抗注射液)获批上市,成为全球第一个上市的肿瘤双免疫检查点双抗新药。另一完全独立自主研发的全球首创的PD–1/VEGF双抗新药依沃西在肺癌领域连续获得了国家药监局药品审评中心(CDE)授予的三项突破性疗法认定。截至2022年12月31日,公司有30多个在研创新项目,涵盖肿瘤、自身免疫及代谢性疾病领域。17个处于临床试验阶段(包括4个对外授权的产品),其中包含6个潜在全球首创(first-in-class)或同类最佳(best-in-class)双特异性抗体。
公司预期多个新药在2023年首次向NMPA递交新药上市申请,包括依沃西治疗EGFR-TKI耐药的EGFR突变NSCLC适应症的首次新药上市申请,自身免疫和代谢疾病领域的依若奇单抗(IL–12/IL–23,AK101)治疗中重度银屑病适应症以及伊努西单抗(PCSK9,AK102)2项治疗高胆固醇血症适应症的首次新药上市申请等。在2023年1月,安尼可®联合化疗一线治疗sq-NSCLC已经获批上市。创新药物销售收入不断突破,进一步夯实公司的药物研发、生产、销售的一体化高效循环体系。
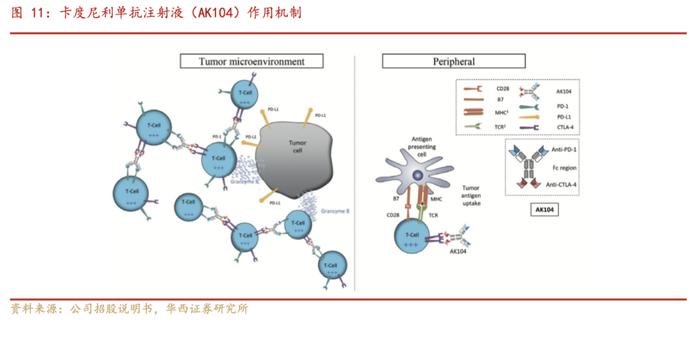
2.1.卡度尼利(AK104):全球首创的双特异性抗体新药
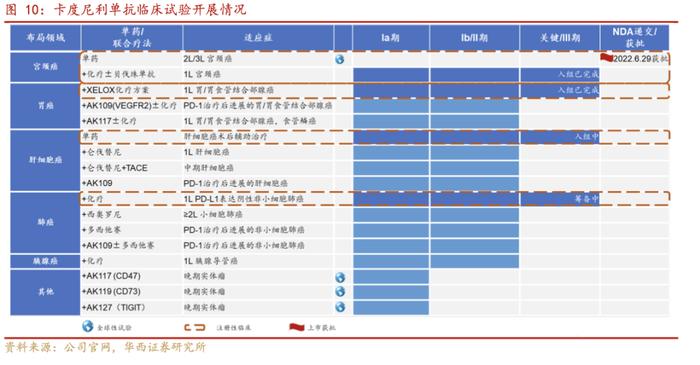
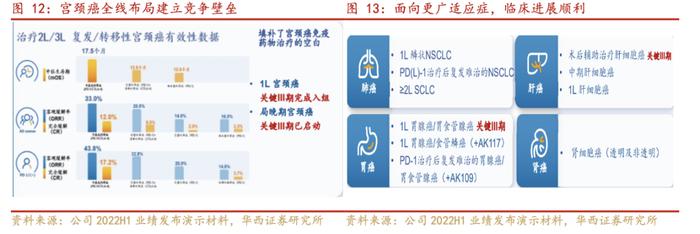
卡度尼利(AK104)所涵盖的适应症广泛,临床试验多进入三期阶段:卡度尼利单抗注射液(AK104)是康方生物自主开发的PD-1/CTLA-4双特异性抗体新药,适应症为既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。开坦尼®(卡度尼利单抗注射液)于2022年6月29日获国家药品监督管理局批准,成为世界上第一个肿瘤双免疫检查点双抗新药。目前,开坦尼®涉及一线宫颈癌、一线胃癌、肝癌等大适应症的注册性/III期临床研究已经在高效推进中,其中一线治疗宫颈癌及胃癌临床试验已经入组完成。开坦尼®为公司第二款自主研发的上市产品,也是首款公司自主负责商业化的产品。开坦尼®的获批上市,为晚期宫颈癌患者送来高效全新的治疗方案,也填补了中国晚期宫颈癌的免疫药物治疗的空白。
AK104是一种首创人源四聚体双特异性抗体药物,能够同时靶向两个经过验证的免疫检查点分子:程序性细胞死亡蛋白1(PD-1)及细胞毒性T淋巴细胞相关蛋白4(CTLA-4),可以更好地黏附在T细胞表面。该药物在肿瘤环境中显示出更高的功能性亲和力,并能降低活化T细胞攻击外周位点健康组织的倾向,使其可以保留PD-1及CTLA-4单克隆抗体联合疗法的疗效,同时提升了联合疗法的安全性。
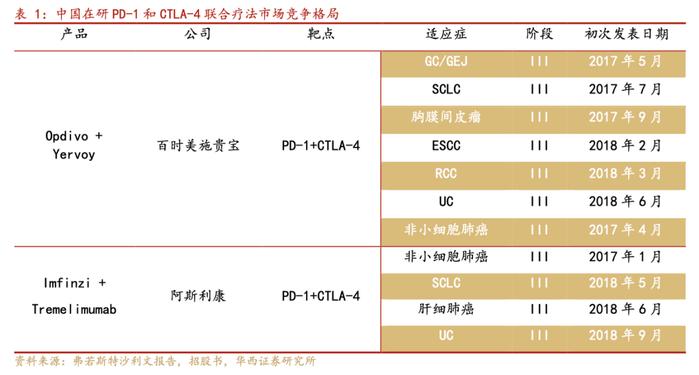
PD-1与CTLA-4的双抗体联合疗法中,Opdivo与Yervoy的组合是唯一获得FDA批准的疗法,分别于2016年1月、2018年4月及2018年7月获准用于治疗不可切除或转移性黑色素瘤、中度或不良风险的晚期肾细胞癌及MSI-H或dMMR转移性CRC。
开坦尼®作为中国第一个双特异性抗体新药,从披露的临床研究数据来看,其呈现了“单药双靶点”的特性,对比现有治疗药物拥有显著的疗效优势。PD-(L)1/CTLA-4双特异性抗体疗法的总潜在市场规模与其潜在可治疗患者群体人数相关。PD-(L)1/CTLA-4双特异性抗体(如AK104)的潜在可治疗患者群体包括对PD-(L)1单一疗法、CTLA-4单一疗法或两者联合疗法有反应的癌症患者,包括曾对治疗有反应但再复发的患者。
2.1.1.宫颈癌:二线治疗效果显著,正积极推进一线治疗
根据公司官网中国的宫颈癌发病人数高居全球第二,2020年新发病例逾十一万。
a)二线宫颈癌治疗效果显著:
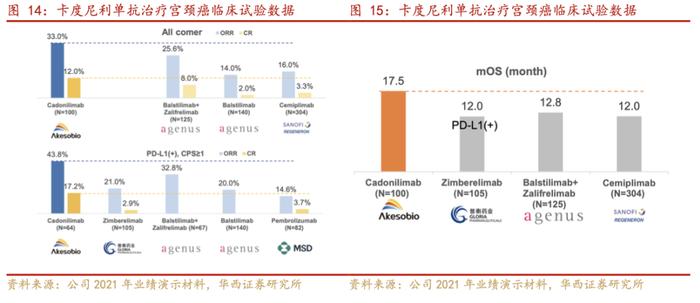
无论是与单一疗法还是联合疗法相比,卡度尼利单抗都有效提高了缓解率,延长了患者总生存期:在100例可评估疗效的患者中,客观缓解率(ORR)为33.0%,其中完全缓解(CR)率为12.0%,6个月和12个月缓解持续时间(DoR)率分别为77.6%和52.9%。中位无进展生存期(PFS)为3.75个月,中位总生存期(OS)为17.51个月。在64例PD-L1阳性(CPS≥1)患者中,ORR为43.8%,中位PFS为6.34个月,中位OS未达到。安全性方面:111例患者中,≥3级治疗相关不良反应(TRAEs)发生率为27.0%。
2022年6月,卡度尼利单抗成功获批上市,用于治疗含铂化疗治疗失败的复发或转移性宫颈癌。同时,卡度尼利单抗已获2022版CSCO宫颈癌指南推荐,位列复发或转移性宫颈癌2L免疫治疗第一顺位。
b)积极推进一线治疗,临床入组已完成:
根据公告一线治疗复发/转移性宫颈癌的II期临床研究已在2022年美国临床肿瘤学会(ASCO)年会以口头报告形式发布:是一项针对全人群复发或转移性宫颈癌的多中心、开放性的II期临床试验(临床试验代码NCT04868708),分别为卡度尼利给药15mg/kg联合含铂化疗,10mg/kg联合含铂化疗,以及卡度尼利给药10mg/kg联合含铂化疗+贝伐珠单抗三个不同对照组。临床研究结果显示,卡度尼利联合含铂化疗+/-贝伐珠单抗一线治疗R/MCC疗法安全性可控,无新的安全信号,在疗效方面,在全人群中显示出良好的疗效数据。
在10mg/kg剂量组中,无论PD-L1表达,卡度尼利联合含铂化疗+/-贝伐珠单抗的客观缓解率(ORR)为79.3%;针对CPS≥1的人群,ORR为82.4%;针对CPS<1的人群,ORR为75.0%;无进展生存时间(PFS)和OS数据尚未成熟。在接受10mg/kg剂量治疗的可评估患者中,PD-L1阴性(CPS<1)患者占比为41.4%。本研究中,≥3级治疗相关不良反应(TRAE)发生率为60.0%。本公司关于卡度尼利联合含铂化疗+/-贝伐珠单抗一线治疗R/MCC的III期临床研究正在进展当中(临床试验代码NCT04982237)。卡度尼利联合同步放化疗治疗局晚期宫颈癌的注册性/III期临床研究正在进展当中(临床试验代码NCT05235516)。
2.1.2.胃癌:1L治疗临床试验数据优秀
世界卫生组织国际癌症研究机构(IARC)发布的统计数据显示,2020中国胃癌发病患者约48万。80%的胃癌患者发现时已处于进展期或转移阶段。对于晚期胃癌的一线治疗,免疫联合化疗已成为标准治疗方案,但单靶点药物的疗效仍然十分有限,尤其相比其他免疫敏感的肿瘤,在有效率和生存期提高幅度方面仍有较大差距。目前国际上已有多项III期研究结果证明了免疫检查点抑制剂联合化疗在GC/GEJC治疗中的协同作用。与PD-1单药治疗相比,抗PD-1和抗CTLA-4药物的联合治疗拥有更高反应率,但单靶点药物联合的毒副作用也更高。
据公司官网,2022年ASCO-GI大会中北京大学肿瘤医院院长季加孚教授的口头报告和截至2021年底的研究结果,开坦尼®联合化疗一线治疗胃癌的II期研究数据显示了其在全人群中的长期生存获益优势和良好的安全性:在PD-L1CPS≥5的人群占比仅为15%的背景下,ORR达68.1%,DCR达92.3%。全人群中位PFS为9.2个月,中位OS为17.08个月,显著优于化疗和相关PD-1疗法。开坦尼®在PD-L1低表达患者中仍维持显著疗效和安全性。PD-L1CPS≥1和CPS<1的患者中,中位OS分别为17.41个月和14.65个月。相对于PD-1单抗,开坦尼®未发现新的安全性信号,安全性良好。
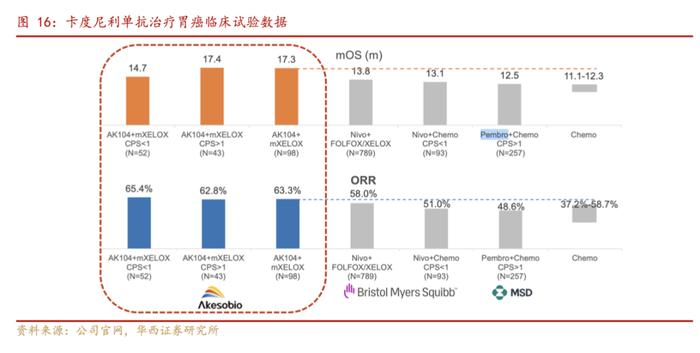
据公司官网,2023月3月14日,公司宣布,开坦尼®联合化疗一线治疗不可手术切除的局部晚期或转移性胃腺癌或胃食管结合部腺癌(GC/GEJC)的关键性III期注册临床研究已完成受试者入组。该临床试验是全球首个PD-1/CTLA-4双特异性抗体联合化疗一线治疗胃癌的临床研究,共入组610例受试者,主要研究终点为比较开坦尼®联合XELOX方案与安慰剂联合XELOX方案在意向治疗(ITT)人群的总生存(OS),预计试验的期中分析时间为2023年底。此外,卡度尼利+AK109(VEGFR-2单抗)±化疗用于PD-1治疗后复发难治GC/GEJ的II期临床研究处于患者入组阶段。
2.1.3.肝癌:1L联用治疗方案疗效更优,术后辅助积极推进
肝癌是在中国发病率位居前列的实体瘤,根据公司官网,卡度尼利单抗联合仑伐替尼一线治疗不可切除肝癌的Ⅱ期临床研究:ORR达44.4%,DCR达到77.8%,相对于阿替利珠单抗+贝伐珠单抗、帕博利珠单抗+仑伐替尼、信迪利单抗+仑伐替尼联用方案,都显示出了更优疗效。卡度尼利联合仑伐替尼和经动脉化疗栓塞(TACE)用于治疗不可切除、非转移性肝细胞癌的Ib/Ⅱ期临床研究正在进行中。
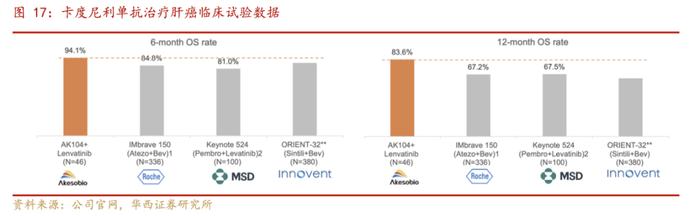
同时高复发风险肝细胞癌根治术后辅助治疗的Ⅲ期临床研究正在进行中:据GLOBOCAN2020统计数据,2020年全球肝癌新发病例90.6万。中国约42.3万例,占全球肝癌新发病例46.7%。目前我国肝癌5年生存率仅为12.1%。肝细胞癌(HCC)是最常见恶性肿瘤之一,占原发性肝癌85%~90%,而且发病率呈上升趋势。约30%的HCC诊断时为早期,而对于肝功能良好的早期HCC,手术切除是首选治疗方案。但手术治疗后,5年复发率达50%~70%,2年复发率高达70%。因此降低术后复发率是提高HCC整体疗效的关键。目前NCCN指南(2022v1)、CSCO指南(2022)等国内外指南均无肝癌术后辅助标准治疗方案推荐。免疫治疗在晚期HCC中的疗效已被证实,而针对免疫治疗在HCC术后辅助治疗中发挥作用的相关研究仍在探索阶段,截至目前尚无相关关键性数据披露。这项HCC辅助治疗的Ⅲ期临床研究,将有望降低早期HCC术后复发率,提高患者远期生存,弥补临床需求的空白。


2.2.派安普利单抗(AK105):差异化新型PD-1单抗
2.2.1.新型差异化设计
公司与中国生物制药有限公司共同开发的安尼可®(派安普利单抗注射液,PD-1)于2021年8月在中国获NMPA批准上市,在2022年全年实现产品销售额人民币5.58亿元,较2021全年增长164%。根据公司官网三项适应症于2022年4月被纳入2022版更新CSCO指南,分别为治疗复发/难治性霍奇金淋巴瘤(r/rcHL)、联合化疗一线治疗鳞状NSCLC、二线治疗或挽救治疗复发/转移性鼻咽癌(r/mNPC)。2023年1月,NMPA批准安尼可®联合化疗用于一线治疗局晚期或转移性鳞状非小细胞肺癌的上市申请,此次新适应症获批将有助于开拓肺癌领域的更大的市场价值。
据公司官网,2023年4月12日,康方生物(9926.HK)宣布公司与中国生物制药旗下正大天晴药业集团共同合资的正大天晴康方与SpecialisedTherapeutics(ST)公司签署了一项合作与许可协议,以授予其公司自主研发的安尼可®(PD-1单抗,派安普利单抗注射液)在澳大利亚、新西兰、巴布亚新几内亚,以及新加坡、马来西亚等东南亚11个国家的独家销售权。正大天晴康方仍保留安尼可®在全球范围内的开发权益。该合作总对价约7300万美元,同时正大天晴康方将获得安尼可®于授权地区销售净额15%的提成。
新型差异化设计:
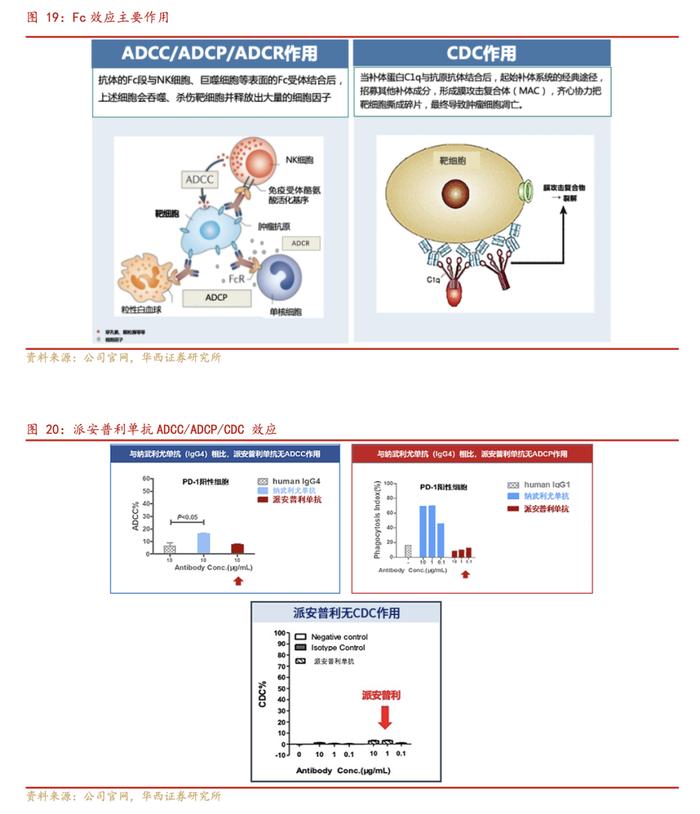
安尼可®(PD-1单克隆抗体,派安普利单抗注射液)是目前全球唯一采用IgG1亚型并进行Fc段改造的新型差异化PD-1单抗,能够更有效增强免疫治疗疗效,且减少不良反应,用于治疗肺癌、淋巴瘤、鼻咽癌、肝癌、胃癌等重大疾病,临床研究显示出优越的安全性和疗效性:
①IgG1亚型:稳定性是天然IgG4的100倍以上,为疗效的发挥提供保障;不与其他IgG结合,不会介导免疫逃逸;宿主蛋白残留低,减少因宿主蛋白引起的发热、输注反应等;
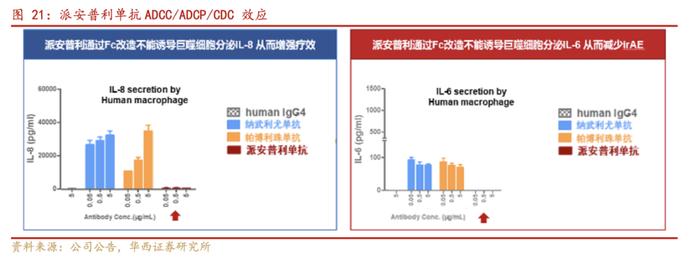
②Fc改构:完全去除ADCC/ADCP/CDC效应,避免免疫细胞被吞噬或杀伤;减少ADCR效应,减少IL-8释放增强疗效,减少IL-6释放降低irAE;
③Fab优化:与PD-1结合紧密、解离缓慢、EC50低,有效激活免疫细胞活性特异性强,不会因激活其他通路引起不良反应。
由于药物的靶细胞为T细胞,所以ADCC/ADCP/CDC效应反而会造成T细胞的损耗,ADCR所产生的IL-6(白介素6)和IL-8(白介素8)等炎症细胞因子会介导免疫性相关不良反应。派安普利单抗是目前唯一采用IgG1亚型并进行Fc段改造的新型PD-1单抗,在重链Fc端利用基因工程技术进行氨基酸突变,形成Fcsilencing,消除与Fc受体结合的能力。从结果来看,这样的改造一方面完全去除ADCC/ADCP/CDC效应,显著减少效应T细胞耗损。此外,Fc段改造降低ADCR效应,减少IL-8的释放,进一步增强免疫疗效。ADCR效应的降低还意味着IL-6的释放减少,从而减少免疫相关不良反应,表现为临床数据上安全性的提升。
2.2.2.多项适应症陆续上市
a)经典型霍奇金淋巴瘤疗效良好:
霍奇金淋巴瘤是一类累及淋巴结及淋巴系统的恶性肿瘤,其中经典型霍奇金淋巴瘤(cHL)最为常见,约占霍奇金淋巴瘤的95%,多发生于15-30岁和55岁以上这两个年龄阶段。尽管联合化疗和放疗的初始治疗使得经典型霍奇金淋巴瘤治愈率较高,但一线治疗后仍有10%~30%的复发率,而且约5%~10%的患者存在原发性难治性疾病。针对复发/难治性经典型霍奇金淋巴瘤的治疗近年虽已有多种药物获批上市,但临床上仍然期待更加安全、有效的药物。
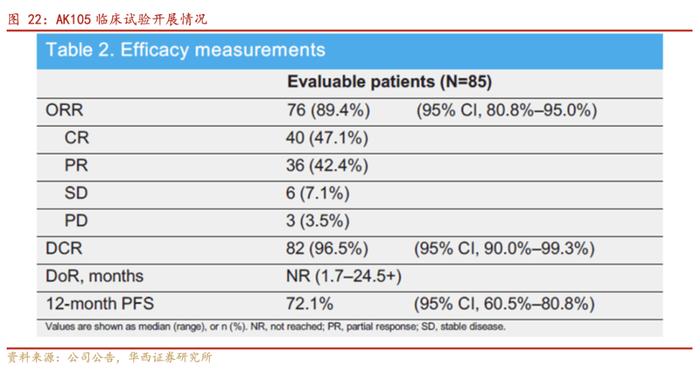
针对接受过至少二线系统化疗治疗失败的复发或难治性经典型霍奇金淋巴瘤患者,使用派安普利单抗200mg静脉输注,每2周1次给药,直至疾病进展或出现不可接受的毒性,主要研究终点是由独立影像评估委员会IRRC评估的客观缓解率(ORR)为89.4%(76/85)。共有47.1%(40/85)的患者达到完全缓解率(CR)。中位随访时间为15.8个月。12个月缓释持续时间(DoR)率为74.9%。12个月无进展生存期(PFS)率为72.1%。
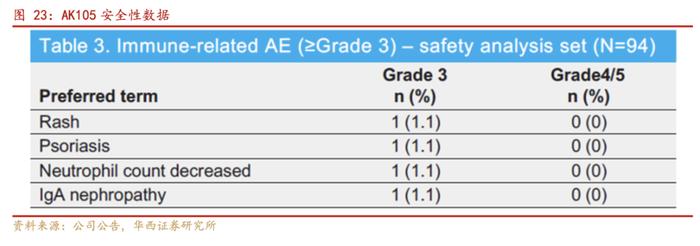
安全性方面,派安普利单抗的中位暴露时间为14.8个月,76.6%的患者派安普利单抗治疗≥12个月。与派安普利单抗相关的严重不良事件(SAE)发生率为10.6%,未发生超过1例患者的与药物相关的SAE。3级及以上的不良反应发生率为26.6%,发生率≥2%的包括皮疹、高脂血症、肺部感染。3级免疫相关不良事件(irAEs)的发生率为4.3%,未发生3级以上irAEs。
b)肺癌、鼻咽癌等多种实体瘤指南推荐:
根据公司官网2022年中国临床肿瘤学会(CSCO)指南更新,派安普利联合紫杉醇和铂类一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC)、治疗复发或难治性经典型霍奇金淋巴瘤(r/rcHL)、治疗复发或转移性鼻咽癌(NPC)以及治疗复发或转移性鼻咽癌的二线或挽救治疗,相应地被写入2022版《CSCO原发性NSCLC指南》《CSCO淋巴瘤诊疗指南》《CSCO鼻咽癌诊疗指南》,以及《CSCO免疫检查点抑制剂临床应用指南》。
派安普利联合紫杉醇和铂类一线治疗晚期鳞状NSCLC列为Ⅱ级推荐:主要基于上海市胸科医院韩宝惠教授牵头的一项随机双盲多中心研究(AK105-302)。在研究中,较对照组,派安普利单抗联合化疗组作为一线治疗局晚期或转移性鳞状非小细胞肺癌在所有疗效终点中均显示出一致的疗效获益,显著降低疾病进展或死亡风险,安全性可控。mPFS7.0个月vs4.2个月,HR=0.40,降低疾病进展风险60%;ORR为69.7%vs43.4%,肿瘤控制佳。
派安普利治疗复发或难治性经典型霍奇金淋巴瘤(cHL)列为Ⅰ级推荐:主要基于AK105-201的研究结果,在研究中派安普利单抗为复发/难治性经典型霍奇金淋巴瘤患者带来显著的临床获益:截至2020年8月4日,派安普利单抗治疗ORR为89.4%,CR率为47.1%,中位PFS未达到,12个月时PFS率72.1%,18个月时OS率为100%,中位DoR未达到。派安普利单抗已于2021年8月被NMPA批准上市,用于治疗至少经过二线系统化疗复发或难治性经典霍奇金淋巴瘤。此次被纳入CSCO指南推荐,进一步奠定了其在复发/难治性cHL中新的标准治疗的地位。
派安普利治疗复发或转移性鼻咽癌的二线或挽救治疗列为Ⅲ级推荐:基于派安普利单抗在接受两线或多线化疗后进展的转移性鼻咽癌患者的II期研究(AK105-202)的显著获益。111例可评估患者的ORR达29.7%,DCR为49.5%,中位PFS为3.65个月,总人群中位OS为18.63个月。2021年8月,派安普利单抗三线治疗转移性鼻咽癌上市申请获NMPA受理,即将建立晚期鼻咽癌治疗新标准。此外,康方生物关于派安普利单抗联合化疗对比安慰剂联合化疗一线治疗复发或转移性鼻咽癌的随机、双盲、多中心、Ⅲ期研究亦在开展中。
2.2.3.市场规模逐渐扩大
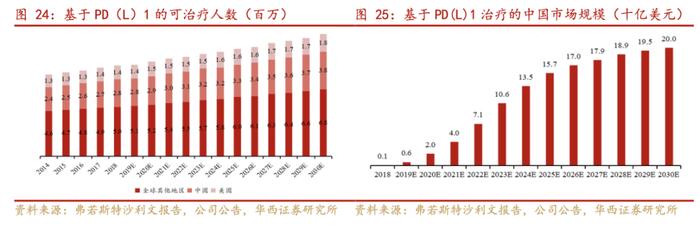
目前,国内与派安普利单抗适应症相同的信迪利单抗、卡瑞利珠单抗、替雷利珠单抗均在医保内。同时,中国还有一批目前处于研发阶段后期的PD-1及PD-L1的单克隆抗体管线。这些疗法预期提高参透率及在整个免疫肿瘤治疗市场上取得更大份额。
2.3.AK112:开创肿瘤免疫新时代
2.3.1.AK112同时阻断双通路,抗肿瘤活性更强:
依沃西(AK112)是康方生物研发管线中一款全球首创的双特异性抗体,其是基于康方生物独特的TETRABODY技术设计,全球行业内首个进入临床研究的自主研发的PD-1/VEGF双抗药物。依沃西(AK112)有望成为继卡度尼利之后又一款具有全球突破性的重磅双抗新药。基于创新性机制和临床优势,依沃西被国家药品监督管理局药品审评中心(CDE)纳入突破性治疗品种,加速其在NSCLC上的适应症开发。
AK112的作用机制在于同时阻断双通路。在阻断PD-1与PD-L1和PD-L2的结合的同时,其还可以阻断VEGF与VEGF受体的结合。PD-1抗体与VEGF阻断剂的联合疗法已在多种瘤种(如肾细胞癌、非小细胞肺癌和肝细胞癌)中显示出强大的疗效。鉴于VEGF和PD-1在肿瘤微环境中的共表达,与联合疗法相比,AK112作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。
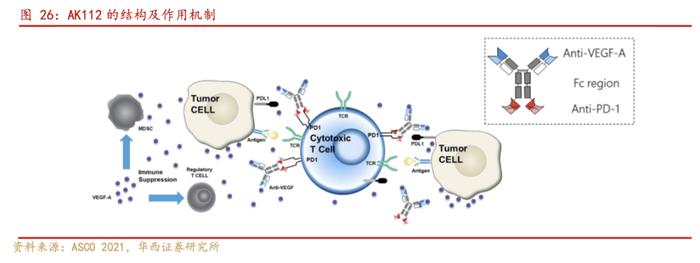
AK112可与人PD-1和VEGF特异性结合且高亲和力,通过ELISA、Fortebio和流式细胞法评估AK112与PD-1和VEGF的抗原结合活性,发现分别相较于贝伐珠单抗和纳武利尤单抗,AK112可与人VEGF和PD-1特异性结合且亲和力更好或相当。

2.3.2.适应症布局广泛,肺癌临床试验领先
核心双抗AK112(PD-1/VEGF双抗)适应症广泛,目前涵盖了肺癌、卵巢癌、子宫内膜癌、胃腺癌/胃食管腺癌,膀胱癌,胰腺导管腺癌、头颈鳞癌、结直肠癌等多个癌种。其中,肺癌临床试验进展较快,已经全面布局了各肺癌分型,治疗EGFR-TKI治疗进展的NSCLC在2021年进入III期临床研究阶段,目前已完成入组。
目前,AK112已有多项临床研究进入III期阶段:包括AK112联合化疗治疗EGFR-TKI耐药的EGFR突变的晚期nsq-NSCLC的III期临床研究,以及AK112单药一线治疗PD-L1+的NSCLC的III期临床研究,同时基于本药物之前在肺癌领域的多项II期临床研究成果以及帕博利珠单抗在肿瘤免疫领域的地位。
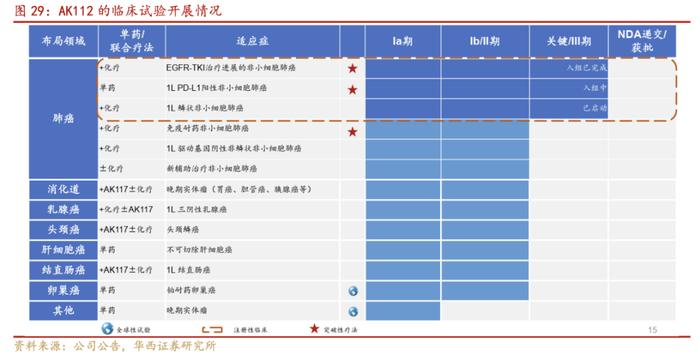
1.PD-1/VEGF双抗治疗EGFR-TKI耐药的nsq-NSCLC:
根据公司官网2022年11月4日,公司宣布依沃西联合化疗治疗经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗耐药的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(nsq-NSCLC)的注册性III期临床试验已完成受试者入组。该III期研究完成入组仅用时约9个月。该研究是全球首个PD-1/VEGF双特异性抗体治疗EGFR-TKI耐药的非小细胞肺癌的III期临床试验,主要研究终点为IRRC评估的无进展生存期(PFS)。此前已被国家药品监督管理局药品审评中心(CDE)纳入突破性治疗品种名单。
2022美国临床肿瘤学会(ASCO)上披露的II期临床研究结果显示:依沃西单抗治疗EGFR-TKI耐药的EGFR突变的晚期nsq-NSCLC的ORR为68.4%,DCR为94.7%;中位PFS为8.2个月,6个月PFS率为69.3%。依沃西单抗有望为该类患者提供一种全新高效的治疗方案。对于EGFR突变阳性的NSCLC患者,靶向治疗为一线标准治疗,但是绝大多数患者后期耐药问题无法避免。含铂双药化疗仍是靶向治疗耐药后最主要的治疗手段,但疗效十分有限,存在巨大的未满足临床需求。
2.PD-1/VEGF双抗(AK112)单药治疗晚期NSCLC的Ib/II期临床研究:
根据公司官网2022年美国临床肿瘤学会(ASCO)年会上,公司以壁报形式发布自主研发的PD-1/VEGF双特异性抗体AK112治疗晚期非小细胞肺癌(non-small-celllungcancer,NSCLC)的Ib/II期临床研究数据。数据显示,与Bevacizumab(贝伐珠单抗)相比,AK112患者的出血风险显著降低,在咯血/肺出血和高血压测试项目中,AK112的表现要明显更优秀,所以安全性有体现。与Pembrolizumab(SOC)相比,AK112单药治疗PD-L1(+)NSCLC的抗肿瘤活性有潜在优势。
在至少有一次治疗后肿瘤评估的54例PD-L1阳性(PD-L1TPS≥1%)的初治晚期NSCLC患者中:客观缓解率(ORR)为50.0%,疾病控制率(DCR)为96.3%。在接受AK112>10mg/kgQ3W剂量治疗的50例初治患者中,不同PD-L1表达水平患者均有良好的抗肿瘤疗效:
PD-L1TPS≥1%时,ORR为60.0%,DCR为97.1%。
PD-L1TPS为1%~49%时,ORR为50.0%,DCR为95.5%。
PD-L1TPS≥50%时,ORR为76.9%,DCR为100%。
截至2022年3月4日,共入组96例患者,其中90例患者至少进行了一次治疗后肿瘤评估。这项剂量发现研究共分为10mg/kgQ3W,20mg/kgQ2W,20mg/kgQ3W或30mg/kgQ3W四个剂量水平,主要终点为安全性和客观缓解率。
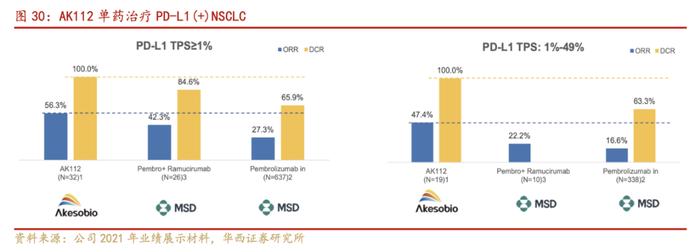
根据公司官网相较于PD-1/L1单抗联合化疗+/-抗血管生成药物,AK112联合化疗也展现出更好的抗肿瘤活性。数据显示,治疗既往PD-1/PD-L1单抗联合含铂双药化疗失败的晚期NSCLC,ORR为40.0%,DCR为80.0%,6个月PFS率为71.1%,显著高于对照组。
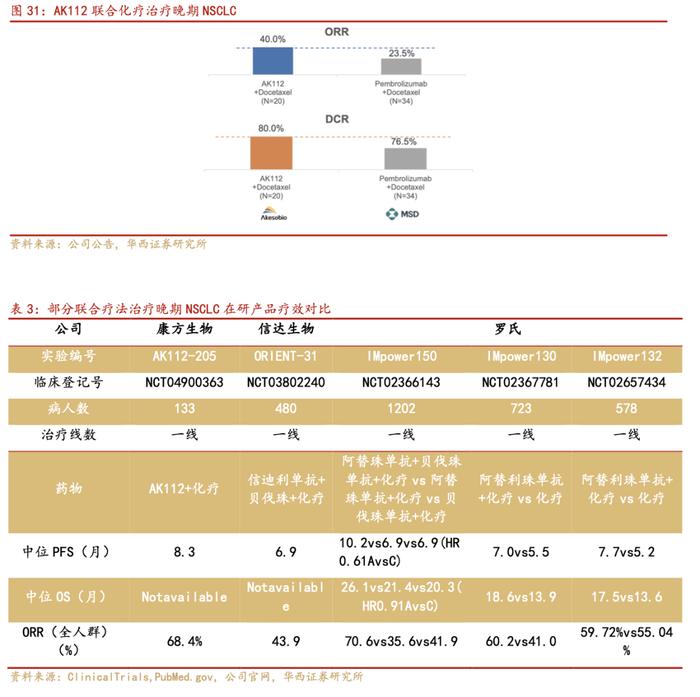
AK112单药治疗晚期NSCLC显示出良好的安全性和耐受性,且在鳞状NSCLC和非鳞状NSCLC中无显著差异。3~4级治疗相关不良反应(TRAE)发生率为13.5%,未发生导致永久停药的TRAE。
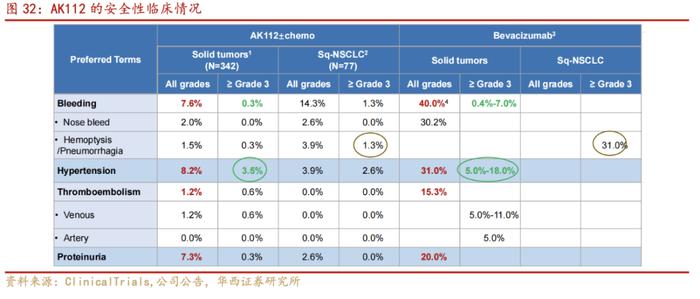
3.PD-1/VEGF双抗(AK112)联合化疗治疗晚期NSCLC的II期临床研究:
根据公司官网2022年美国临床肿瘤学会(ASCO)年会上,公司以壁报讨论形式发布PD-1/VEGF双抗(AK112)联合化疗治疗晚期非小细胞肺癌(non-small-celllungcancer,NSCLC)的II期临床研究数据。研究结果显示:在治疗晚期NSCLC中,AK112联合化疗,相较于PD-1/PD-L1单抗联合化疗+/-抗血管生成药物疗法,展现了更具优势的安全性和耐受性,并具有良好的抗肿瘤疗效。
AK112联合化疗治疗晚期NSCLC在鳞状NSCLC与非鳞NSCLC之间的治疗相关不良反应(TRAE)发生率无显著差异(30.1%的入组患者为鳞状NSCLC,其中52%为中央型鳞状NSCLC);安全性良好,未出现严重出血、穿孔等VEGF靶点相关不良事件。
相较于PD-1/L1单抗联合化疗+/-抗血管生成药物,AK112联合化疗在不同类型的晚期NSCLC人群中均展现出更好的抗肿瘤活性。
队列1:一线治疗EGFR/ALK野生型NSCLC,整体生存数据优异,鳞癌中优势更突出,全人群中,中位无进展生存期(PFS)未达到,6个月PFS率达78.8%。鳞状NSCLC患者中,中位随访时间为7.9个月,客观缓解率(ORR)为77.8%,疾病控制率(DCR)为100%,6个月的PFS率为83.3%,和目前已获批的PD-1联合化疗联合疗法相比,初步研究数据令人鼓舞。
队列2:治疗EGFR-TKI治疗失败的EGFR突变的晚期非鳞状NSCLC,ORR为68.4%,DCR为94.7%。中位PFS为8.2个月,6个月PFS率为69.3%。
队列3:治疗既往PD-1/PD-L1单抗联合含铂双药化疗失败的晚期NSCLC,ORR为40.0%,DCR为80.0%。中位PFS为6.6个月,6个月PFS率为51.1%。
中山大学肿瘤防治中心张力教授为主要研究者,这项多队列、多中心Ⅱ期临床研究(NCT04736823)结果表明,PD-1/VEGF双抗AK112联合化疗治疗晚期NSCLC具有巨大的潜力空间,尤其是该疗法在鳞状NSCLC中的安全性结果,在避免了“抗血管生成”机制可能带来的严重出血风险障碍的同时,充分发挥了“免疫+抗血管生成”的协同抗肿瘤效应,大大提升了疗效空间。截至2022年3月20日,本研究共有83例晚期NSCLC受试者接受AK112联合化疗治疗,最长给药时间约12个月,平均给药时间7.56个月。
4.PD-1/VEGF双抗(AK112)单药或联合化疗新辅助/辅助治疗可切除非小细胞肺癌的II期临床研究:
根据公司官网2022年3月24日公司宣布PD-1/VEGF双抗(研发代号:AK112)单药或联合化疗新辅助/辅助治疗可切除非小细胞肺癌的开放、多中心II期临床研究已完成首例患者入组。
对于可切除NSCLC,手术是标准治疗的基石,但仍有30%至55%的非转移性NSCLC患者在接受手术治疗后出现复发。多项临床研究结论显示,新辅助免疫疗法在早期NSCLC的综合治疗中可发挥重要作用,且不良反应可控,有望延长患者的无病生存期。根据NSCLC新辅助免疫治疗共识:可切除的IB-IIIA期NSCLC患者可考虑手术前使用新辅助免疫治疗联合含铂双药化疗或新辅助免疫单药治疗。免疫治疗联合化疗的疗效优于化疗,安全性可控,但改善病理完全缓解率有限。
2.3.3.多款联合疗法已获批
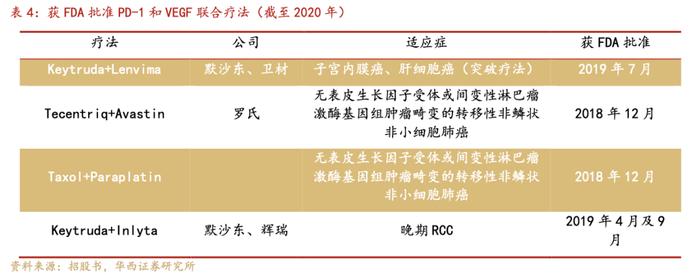
关于PD-1与VEGF进行联合疗法,全球有多项临床试验对PD-1单抗和VEGF阻断抗体或小分子抑制剂的联合疗法进行了探索。以下为截至2020年获得FDA监管批准的研发情况。
2.4.AK117:自主研发的二代CD47单抗
AK117是一种靶向CD47的人源化单克隆抗体,CD47在体内表达较为广泛,具有调节吞噬作用的功能。CD47作为表达于巨噬细胞等先天免疫细胞的受体SIRPα的配体,可与SIRPα特异性结合,传递抑制吞噬作用的信号,从而屏蔽巨噬细胞的吞噬功能。CD47已成为继PD-1/PD-L1及CTLA-4之后的新一代免疫肿瘤学疗法的热门靶点,CD47靶点成药理论上具有广阔的前景,但是其最不可回避的是安全性问题:由于人体内红细胞表面同样表达CD47,因此以CD47为靶点的治疗药物在杀伤肿瘤细胞的同时不可避免地会误伤红细胞,造成血液毒性问题,因此严重限制其临床应用。
AK117有望在临床实践中带来更好的疗效、安全性,以及适应症的拓展:
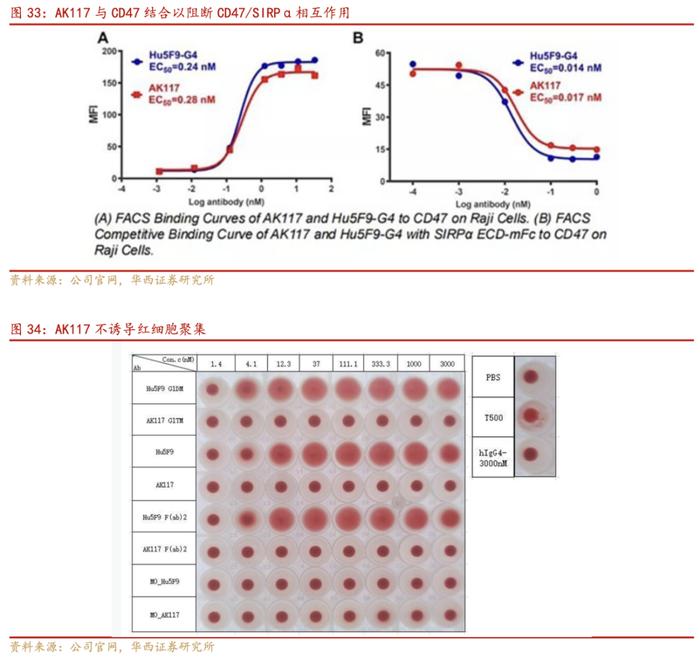
1)具有较好的抗体结合活性,可高效阻断SIRPα与CD47相互作用:AK117可高亲和力特异性结合人CD47,竞争性结合活性与Hu5F9-G4相当。
2)不引发红细胞凝集,其机制可能与CD47的结合表位有关:AK117不会诱导人红细胞的血凝反应,且直到3000nmol/L仍不会引起人红细胞凝集;相比之下,Hu5F9-G4在浓度≥4.1nmol/L就会诱导人红细胞凝集。
3)可诱导巨噬细胞的肿瘤吞噬,在小鼠模型中抗肿瘤活性良好:AK117剂量依赖性地诱导巨噬细胞对肿瘤细胞的强吞噬作用,与Hu5F9-G4活性相当。AK117在小鼠模型中产生的抗肿瘤活性和Hu5F9-G4治疗疗效无显著差异。
4)单药或联合AK112显示出显著的抗肿瘤活性:AK117单药或联合AK112(PD-1/VEGF双抗)在小鼠模型中抗肿瘤疗效明显,抗肿瘤活性良好。
5)AK117较Hu5F9-G4,安全性优势突出:在食蟹猴中的毒理学研究数据显示,AK117不引起红细胞凝集,与Hu5F9-G4相比,AK117引起贫血的程度更轻,且快速恢复,安全性更好。
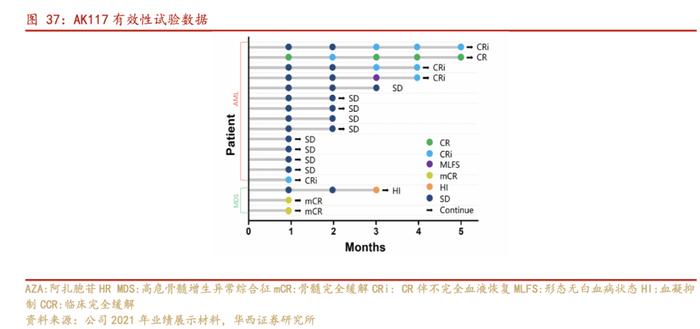
公司充分利用自身丰富的在研管线,针对血液瘤和实体瘤,全力推动AK117多项联合疗法的临床研究,以加速AK117的开发进程。目前,AK117联合阿扎胞苷治疗急性髓系白血病(AML)、骨髓增生异常综合征(MDS)的临床试验都已开展到Ib/II期,并体现出了明显的安全性优势。公司也在积极开展AK117与AK114双抗治疗晚期恶性肿瘤的Ib/II期临床研究。
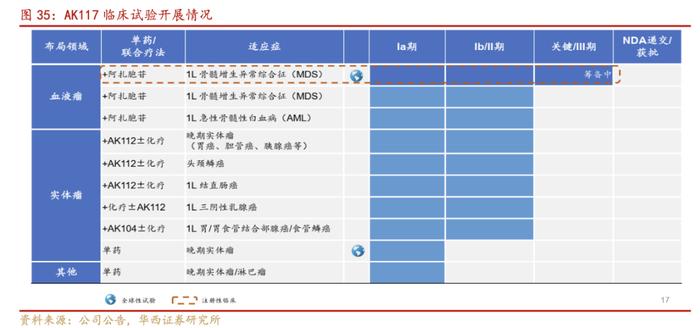
血液瘤:联用阿扎胞苷,一线MDS适应症加速推进。我们预计AK117+阿扎胞苷治疗一线MDS适应症有望在2023H2推进至临床III期阶段。
实体瘤:联用依沃西,头颈鳞癌领域有望迎来突破。AK117+依沃西在晚期实体瘤中已开展4项探索性研究。

在AML和MDS的Ib/II临床试验中,AK117都显示出了理想的抗肿瘤活性。在HRMDS中,3例可评估患者中,ORR=100%(2例mCR,1例HI)。随着治疗时间的延长,预期反应将进一步提高。在14例unfit AML的一线治疗病例中,CCR=35.7%(AZA单药治疗的CCR为23%)。在早期治疗周期达到CR,表明AK117与AZA有协同作用。
2.5.AK101:有望成为首个国产IL-12/IL-23药物
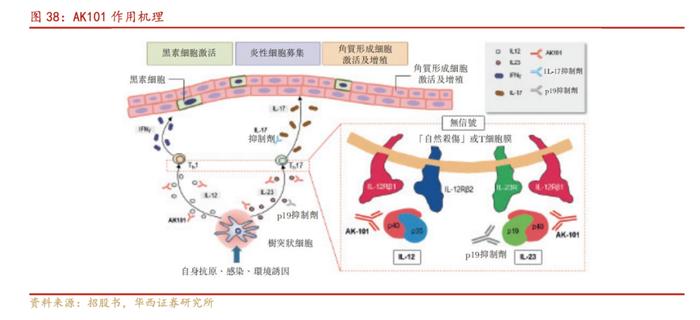
依若奇(AK101)是靶向IL-12/IL-23单抗药物,IL-12及IL-23是炎症反应及免疫反应中自然产生的细胞因子。IL-12及IL-23的结构类似,其中这两种细胞因子的功能和受体结合均需要有共用的亚基p40。AK101就与IL-12和IL-23的p40亚基结合,同时抑制IL-12及IL-23与细胞表面的IL-12Rβ1受体的相互作用,使得Th1和Th17细胞减少,T细胞分泌的IL-17和TNF-ɑ也随之减少。由于p40亚基为IL-12及IL-23所共有,故AK101能够通过IL-12及IL-23各自的受体阻断信号传导。
AK101(依若奇单抗)针对中重银屑病的I/II期临床疗效:
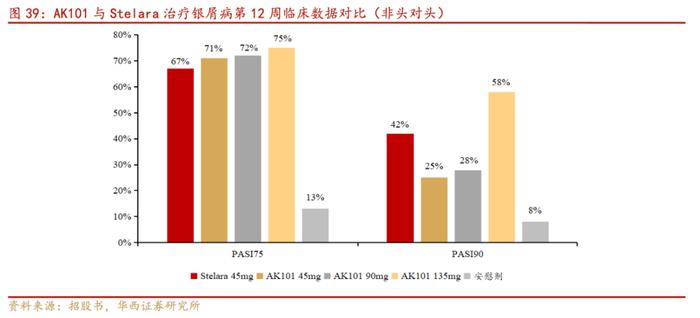
根据公司招股书公司一共招募96名中重度银屑病受试者参加研究,根据队列分配接受AK101(n=72)或安慰剂(n=24)的皮下给药。临床试验开展情况与强生的Stelara相比(非头对头),AK101治疗银屑病疗效数据相似。AK101给药第12周显著优于安慰剂组。并且基于第12周PASI90反应(PASI75和PASI90为银屑病面积及严重性缓解程度),高剂量水平的AK101所拥有的疗效似乎优于Stelara(接近45毫克水平)。
银屑病是一种加快皮肤细胞生命周期,导致细胞在皮肤表面快速堆积并形成发痒、偶尔引起疼痛的鳞屑和红色斑块的皮肤疾病。目前中重度银屑病的治疗手段包括光疗法和系统免疫调节剂。
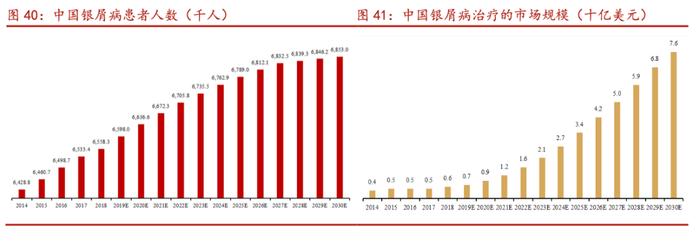

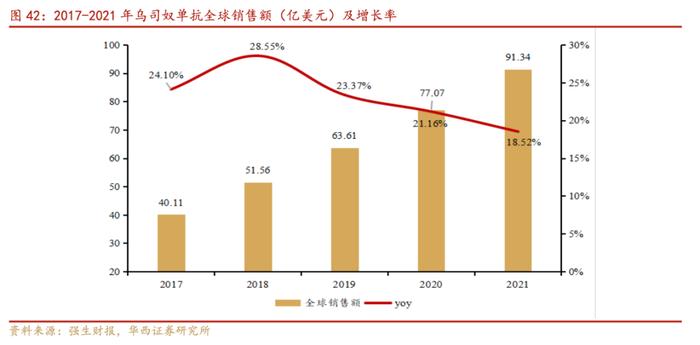
强生的乌司奴单抗已经在国内上市,用于治疗克罗恩病和斑块状银屑病。乌司奴单抗在国内上市之初定价较高,于2021年通过谈判纳入国家医保目录后患者可及性大幅提高,仍处于市场开拓阶段。
国内乌司奴单抗生物类似药的研发格局如下表所示

2.6.AK102:PCSK9单克隆抗体
伊努西(PCSK9单抗,AK102)是由康方生物与东瑞制药共同开发的针对有原发型高胆固醇血症和混合型高脂血症,包括杂合子家族性高胆固醇血症(HeFH)及同时患有动脉粥样硬化性心血管疾病的高胆固醇血症患者。AK102与安进的Repatha(依伏库单抗)和赛诺菲╱再生元的Praluent(阿利库单抗)具有相同的靶点。目前,AK102已完成治疗原发性高胆固醇血症和混合型高脂血症大规模关键注册性III期临床试验,以及治疗杂合子家族性高胆固醇血症的注册性III期临床试验均已经完成。
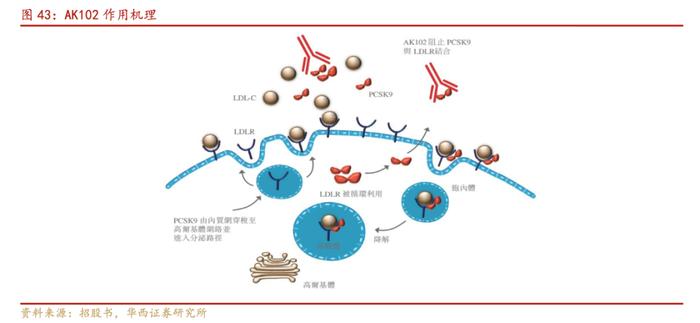
AK102为创新PCSK9单克隆抗体,通过与前蛋白转化酶枯草溶菌素/Kexin9型(PCSK9)结合而抑制PCSK9与低密度脂蛋白胆固醇(LDL)受体(LDLR)的结合,继而恢复LDL-R的循环利用并吸收LDL-C。从而有效降低心血管疾病患者LDL-C水平。在他汀药物背景治疗基础上使用PCSK9单抗,已证明可显著降低胆固醇,并降低患者心脏病发作或中风的发病率。
AK102临床试验开展情况
2021年9月AK102治疗高胆固醇血症心血管极高危或高危患者的随机、双盲、安慰剂对照、多中心II期临床研究达到主要终点,结果显示AK102在治疗高胆固醇血症患者中展现了良好的有效性和安全性特征:使用AK102连续治疗12周后,与安慰剂相比,各剂量组空腹血清低密度脂蛋白-胆固醇(LDL-C)水平均获得显著改善,与同靶点已上市产品显示相似的疗效。450mgQ4W可使LDL-C相对于基线下降65.48%,较安慰剂合并组下降65.69%;150mgQ2W可使LDL-C相对于基线下降63.69%,较安慰剂合并组下降63.90%。同时,AK102整个治疗期间安全性良好,与同靶点已上市PCSK-9单抗报道的安全性特征相似。发生率>5%且高于安慰剂的药物相关不良事件仅包括注射部位不良反应。
根据公司官网2022年11月AK102治疗原发性高胆固醇血症(包括杂合子型家族性高胆固醇血症,HeFH)和混合型高脂血症的随机、双盲、安慰剂对照关键注册性Ⅲ期临床研究成功达到预设终点。该项研究结果显示,在更大规模的原发性高胆固醇血症(包括HeFH)和混合型高脂血症患者中,使用AK102连续治疗12周,各剂量组低密度脂蛋白胆固醇(LDL-C)均可显著下降,展现出优秀的临床疗效。同时,一项随访期最长52周的临床研究结果显示,长期稳定接受AK102治疗可以有效维持前12周观察到的疗效,且安全性良好。目前,另外2项同适应症的关键注册性III期即将完成,每6周给药一次(Q6W)的治疗方案有望为患者提供更灵活和便利的用药选择。
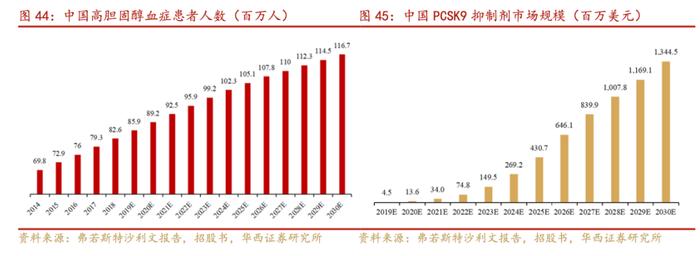
根据弗若斯特沙利文报告,中国高胆固醇血症患者人数预计将在2030年达到116.7百万人,中国PCSK9抑制剂市场规模预计将在2025年达到4.3亿美元,2030年达到13.4亿美元。
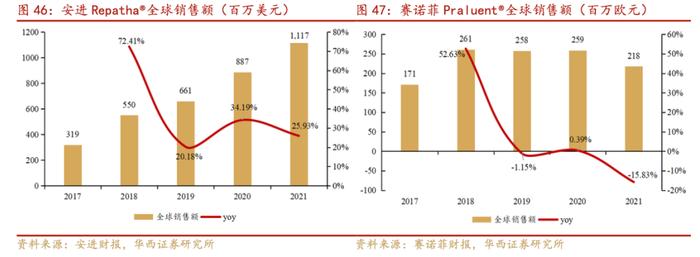
目前,我国国内仅有两款PCSK9抑制剂上市,分别是安进的Repatha®(evolocumab)和赛诺菲再生元共同研发的Praluent®(alirocumab)。Repatha®于2018年上市,2021年实现全球销售额约11.2亿美元;Praluent®于2019年上市,2021年实现全球销售额约2.2亿欧元。
AK102是康方生物自主研发的PCSK9单抗药物,目前已进入原发性高胆固醇血症和混合型高脂血症的III期注册性临床研究。除此之外,君实生物、恒瑞医药的相关药物研发也正处于3期临床,信达生物的IBI306处于NDA阶段。

2.7.IL-17单抗疗效优异
1.治疗中重度银屑病:
银屑病是一种常见的慢性、复发性炎症性皮肤病,主要发病人群为中青年人。全球有超1.25亿银屑病患者,发病率为0.1%~3%,我国发病率由1987年的0.12%上升至2012年的0.47%。银屑病的传统局部和全身治疗疗效有限或长期治疗副作用明显。近年来,以炎性细胞因子为靶点的生物制剂被用于对传统全身治疗反应不佳的中重度银屑病,显示出良好的疗效和安全性。目前以IL-17为靶点的单抗已批准用于银屑病的治疗,由于良好的疗效和安全性使IL-17成为治疗银屑病的热门靶点,但目前尚无我国自主研发的IL-17单克隆抗体批准上市。公司自主研发的AK111是一种靶向IL-17A的人源化IgG1单克隆抗体,可高亲和力特异性结合IL-17A,阻断其与T细胞、自然杀伤细胞和抗原呈递细胞表面表达的IL-17受体A(IL-17RA)结合,从而阻断其下游细胞免疫应答。
根据公司官网与已上市的IL-17抗体相比,AK111在抗原结合试验、细胞学试验和动物模型中表现出相似的活性和安全性。在新西兰完成了健康受试者AK111的Ⅰ期试验验证了AK111的良好的安全性和耐受性。发布于DermatologyandTherapy的Ⅰb期多剂量递增临床研究达到临床主要和次要终点,AK111在中、重度斑块状银屑病中表现出良好的安全性、耐受性和有效性,该Ⅰb期研究是AK111在亚洲人群的首次人体研究,安全性及药代动力学特征与此前在新西兰患者中进行的Ⅰ期研究结果相似。AK111安全性、耐受性普遍良好,并显示出快速优秀的临床反应。所有剂量组均能有效改善银屑病患者皮损状态,并持续至末次给药后至少8周。关键有效终点第12周PASI75、PASI90、PASI100和sPGA0/1应答率方面,AK111各剂量组的应答率均高于安慰剂组。150mg及以上剂量的AK111组的PASI90应答率较75mg剂量组有进一步提升。所有疗效指标均基本维持至末次给药后第8周,300mg和450mg剂量组能进一步维持至末次给药后第12周。AK111在高剂量水平下可使患者获得更好的疗效改善,450mg剂量组安全佳且大多数患者银屑病斑块完全消失。
安全性方面,AK111组中报告任何治疗中出现的不良事件的受试者比例为75.0%,与安慰剂组的66.7%相似。最常见的不良事件(TEAE)是1~2级的高血糖、高血压,无需干预即可解决,且不良反应的发生无明确的剂量反应关系。AK111的75-300mg剂量的半衰期约为26-28天,支持每4周给药(Q4W)的维持给药频率,有助于评估更大给药频率的疗效,为后续临床试验给药方案提供依据。免疫原性方面,治疗后没有检测到抗药物抗体(ADA)或中和抗体(NAb)阳性。
2.强直性脊柱炎:
强直性脊柱炎是累及中轴关节的慢性炎症性疾病,可导致患者脊柱畸形、功能丧失。根据弗若斯特沙利文报告,中国强直性脊柱炎患者约有400万人。
IL-17是强直性脊柱炎发病机制中关键的炎症细胞因子,具有独特的疗效和安全性优势,也展现了很好的商业价值,并已成为新的治疗靶点。根据公司官网同靶点药物Secukinumab、Ixekizumab已被FDA批准用于治疗强直性脊柱关节炎。2020年,IL-17A单克隆抗体药物全球销售金额已达57.83亿美元。目前,国内尚无自主研发的针对IL-17的单克隆抗体药物上市,临床需求强烈。AK111作为国内自主创新药,未来有望为强直性脊柱炎患者带来福音。
Gumokimab(IL-17A单抗,AK111)是康方生物自主研发的靶向IL-17A的新型自身免疫疾病治疗药物,拟用于治疗银屑病、强直性脊柱炎等疾病。gumokimab通过竞争性阻断人IL-17A与IL-17R的结合抑制IL-17的生物学活性,以达到临床治疗免疫相关疾病的功效。Gumokimab已完成中重度斑块型银屑病受试者多次给药皮下注射剂量递增的临床研究,结果提示Gumokimab可显著改善银屑病受试者病情,包括达到PASI100的受试者比例,且安全可耐受。目前Gumokimab治疗中重度斑块型银屑病Ⅱ临床试验所有受试者已经完成主要终点评估,预计将开展Ⅲ期临床。
诺华的司库奇尤单抗和礼来的依奇珠单抗为IL-17A单抗的代表性药物,两者上市后均高速放量,在临床广泛应用,2021年销售额分别达47.2亿、22.1亿美元。两款产品均于2019年在国内获批上市,用于治疗成年患者的斑块状银屑病,上市之初定价均较高,年治疗费用约10万元左右。2020年,司库奇尤单抗经谈判成功纳入医保;2021年,依奇珠单抗经谈判成功纳入医保,降价后患者可及性均大幅提高,促进IL-17A市场的快速放量。


2.8.AK120(IL-4Rα单抗)
AK120是康方生物自主研发的靶向IL-4Rα的新型自身免疫疾病治疗药物,拟用于治疗特应性皮炎、哮喘等过敏性疾病。AK120通过抑制双重细胞因子IL-4和IL-13的生物学活性,以达到临床治疗过敏性自身免疫疾病的功效。根据公司官网AK120已经获得国家药品监督管理局药品审评中心批准,开展治疗中、重度哮喘的II期临床研究。同时,AK120用于治疗中度至重度特应性皮炎的全球II期临床已于美国首家研究中心完成首例患者入组,该研究正快速推进中。
IL-4和IL-13是2型炎症的关键驱动因素。AK120能够与IL-4Rα特异性结合,从而竞争性IL-4、IL-13与IL-4Rα结合,阻断其介导的下游信号转导,从而达到治疗特应性皮炎、哮喘、嗜酸性食管炎等2型炎症为主要发病机制的特应性疾病的目的。
有效性方面,早期临床研究显示,AK120在特应性皮炎患者中表现出相当或更优于度普利尤单抗的潜在临床疗效。临床前药效学也提示了AK120在哮喘方向具有较好的成药性,其可显著降低小鼠哮喘模型肺泡灌洗液中白细胞、嗜酸性粒细胞水平和外周血特异性IgE抗体水平。安全性方面,AK120已经在新西兰和澳大利亚完成了健康受试者的单剂量递增Ia期临床研究和用于治疗特应性皮炎多剂量递增Ib期临床研究。根据研究初步数据,AK120在成人健康受试者(剂量最高达600mg单次给药)及特应性皮炎受试者中(剂量最高达300mg每周一次,多次给药)的安全且耐受性良好。
目前中国仍缺乏拥有自主知识产权的治疗中重度哮喘和中重度特应性皮炎的生物制剂批准上市,临床需求强烈。随着AK120针对特应性皮炎和哮喘等临床研究进入临床开发后期阶段,AK120有望在不久的将来为国内2型炎症为主要发病机制的特应性疾病患者带来新的治疗希望,填补国内临床需求空白。IL-4Rα单抗被认为是治疗过敏性疾病的重要靶点,也是目前最为畅销的自身免疫领域抗体蛋白药物之一。

3.盈利预测及估值
营收关键假设:
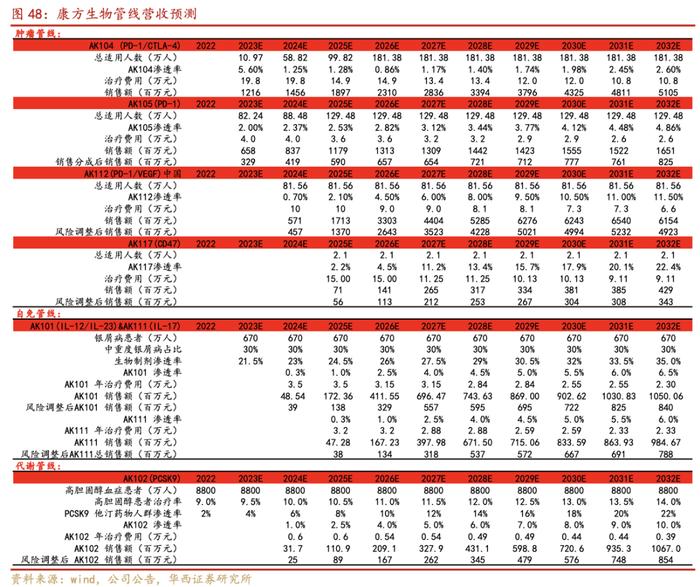
1.AK104(PD-1/CTLA-4)首个适应症2L/3L宫颈癌于2022年6月29日获批上市,成为首个上市的国产双抗品种。后续包括一线宫颈癌、一线胃腺癌/胃食管腺癌、早期阶段肝细胞癌的新辅助治疗等处于临床三期,我们预计未来几年会陆续上市。根据Globocan数据显示每年新增宫颈癌、胃癌、肝癌、肺癌对应国内患者人数分别为10.97/47.85/41/81.56万人,假设AK104治疗年化费用19.8万元/年,从2025年纳入医保降价25%,之后每次降价10%,考虑到AK104为首个国产上市的双抗药物,假设2023-2025年,AK104在中国的渗透率5.6%、1.25%和1.28%,对应2023-2025E销售额分别为12.16/14.56/18.97亿元。
2.AK105派安普利单抗是公司差异化的PD-1单克隆抗体,结构优势明显,派安普利单抗目前已获批上市用于治疗至少经过二线系统化疗复发或难治性经典型霍奇金淋巴瘤患者(r/rcHL),鼻咽癌和非小细胞肺癌、肝癌等适应症有望陆续获批上市。根据Globocan数据显示每年新增淋巴瘤、鼻咽癌、肝癌、肺癌对应国内患者人数分别为0.68/6.24/41/81.56万人,假设AK105年化治疗费用4万元/年,之后每次降价10%。假设2023-2025年,AK105在中国的渗透率2%、2.37%和2.53%,对应2023-2025E销售额分别为6.58/8.37/11.79亿元;假设分销成本比例为50%,对应2023-2025E营业收入分别为3.29/4.19/5.90亿元。
3.AK112是全球首个进入III期临床研究的PD-1/VEGF双特异性抗体。我们预期国内2024年上市,目前包括AK112联合化疗对比化疗在EGFR-TKI治疗失败的EGFR突变的晚期非鳞NSCLC,AK112单药对比帕博利珠单抗单药一线治疗PD-L1表达阳性的NSCLC。根据Globocan数据显示每年新增肺癌对应国内患者人数为81.56万人,假设AK112年化治疗费用10万元/年,之后每次降价10%,假设2024-2025年,AK112在中国的渗透率0.7%、2.1%,对应2024-2025E国内销售额分别为4.57/13.70亿元;
4.AK117(CD47)针对骨髓增生异常综合征,我们预期2025年上市,根据《骨髓增生异常综合征诊疗指南2022》,假设国内总适应人群为2.1万人,年化治疗费用为15万/年,纳入医保后降价25%,之后每次降价10%,AK117在2025年国内渗透率为2.2%,上市成功率为80%,对应2025E营业收入分别为0.56亿元。
5.AK101&AK111:AK101是公司靶向IL-12/IL-23单抗药物,我们预期2024年上市,AK111是公司靶向IL-17单抗药物,我们预期2025年上市;目前主要适应症均为银屑病。根据弗若斯特沙利文预测,假设国内总适应人群为670万人,中重度银屑病占比30%,AK101年化治疗费用为3.5万/年,之后每次降价10%,AK111年化治疗费用为3.2万/年,之后每次降价10%,上市成功率为80%,AK101&AK111对应2024-2025E公司收入分别为0.39/1.76亿元。
6.AK102是公司靶向PCSK9单抗药物,我们预期2024年上市,目前主要适应症高胆固醇血症患者。根据弗若斯特沙利文预测,假设国内总适应人群为8800万人,治疗率10%,之后逐年递增,AK102年化治疗费用为0.6万/年,之后每次降价10%,上市成功率为80%,假设2024-2025E年,AK102在中国的渗透率1%、2.5%,对应2024-2025E公司收入分别为0.25/0.89亿元。
7.其他收入及收益:假设2023-2025E年公司收到政府补助及其他收入为1.5/1.5/1.0亿元。
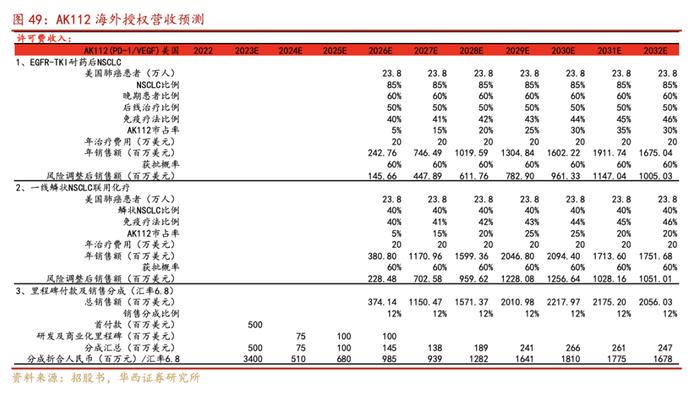
8.海外授权部分:根据Globocan数据显示每年新增肺癌对应美国患者人数为23.8万人,假设AK112美国年化治疗费用20万美元/年,假设销售分成比例为12%,另授权首付款5亿美元已到账,假设2024-2025E公司可获得研发及商业化里程碑付款分别为0.75/1.0亿美元,假设中美汇率按6.8计算,对应2023-2025E公司分成折合成人民币分别为34.0/5.1/6.8亿元。
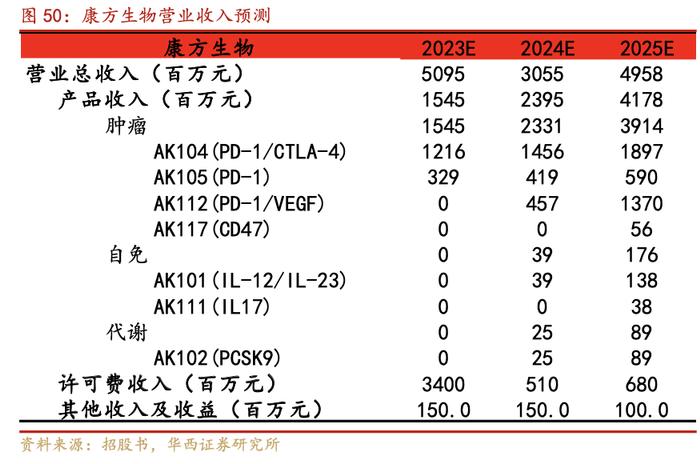
根据以上假设,我们预计公司2023-2025E年营业总收入分别为50.95/30.55/49.58亿元。
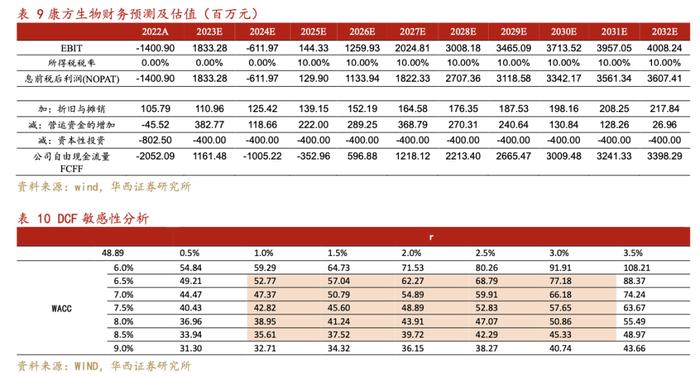
估值假设:
1.估值中不包含在中国区域未实现商业化的品种;估值中不包含临床阶段尚在II期以前的早期管线;
2.毛利率:假设随着公司产品陆续上市,自建管线逐步投产完备,公司产品毛利率将逐步提升并稳定在85%;销售及管理费用:假设公司管理运营团队及商业化队伍基本稳定,随产品扩充自然增长,研发、销售及管理费用率率随着产品的放量逐步下降;
3.所得税率:利润为负时无所得税,为正时假设综合所得税率为10%;
4.DCF估值指标:假设永续增长率2%,β系数为1.5,无风险收益率选取十年期国债收益率为2.73%,假设市场收益率为7.5%,经计算WACC为7.5%;
我们预测2023-2025年公司营业总收入为50.95/30.55/49.58亿元,分别同比增长508%/-40%/62%,归母净利润为14.7/-4.9/1.0亿元,EPS分别为1.74/-0.58/0.12元,对应2023年5月23日收盘价38.45港元,PE分别为22/-66/311X。看好公司产品上市后商业化运营能力,产品持续放量,以及后续创新靶点管线持续不断的推陈出新,采用自由现金流DCF折现估值方法,假设WACC为7.5%,永续增长率为2%,公司估值为411亿元,对应股价48.89元,假设人民币兑换港币汇率为1.15,折合港币56.2元,首次覆盖,给予公司“买入”评级。
4.风险提示
研发不及预期,市场竞争加剧,技术升级及产品迭代风险;商业化推广不及预期,导致药品销售不及预期风险;海外推进不及预期。

注:文中报告节选自华西证券研究所已公开发布研究报告,具体报告内容及相关风险提示等详见完整版报告。
分析师:崔文亮
分析师执业编号:S1120519110002
证券研究报告: 《双抗龙头药企,迎来商业化收获期》
报告发布日期:2023年05月30日
作者具有中国证券业协会授予的证券投资咨询执业资格或相当的专业胜任能力,保证报告所采用的数据均来自合规渠道,分析逻辑基于作者的职业理解,通过合理判断并得出结论,力求客观、公正,结论不受任何第三方的授意、影响,特此声明。
