推荐阅读 | FDA:CMC文件的标准化递交和评估
2023-11-02 08:01:22 - 市场资讯
转自:注册圈
在2023年4月12日至13日的SBIA制药论坛上,FDA分享了最新的药品质量/药学文件的标准化递交和评估:关于药学文件的知识辅助评价和结构化申请(KASA)。


当前药学M3文件递交模式仍是非结构化的PDF形式提交,不被视为“数字化”,将来药学M3文件递交模式是结构化的数据和文件形式提交,便于各种数据自动化的输入FDA数据系统中。
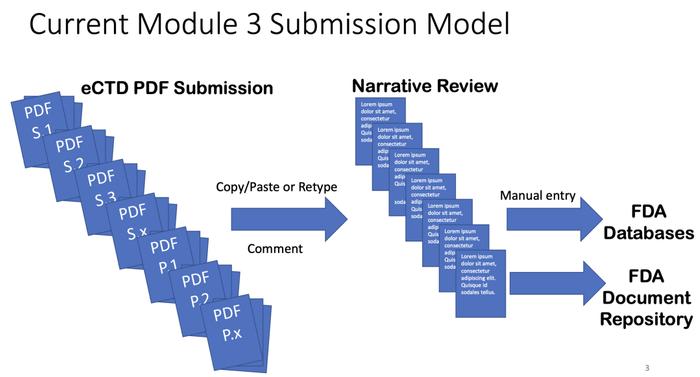
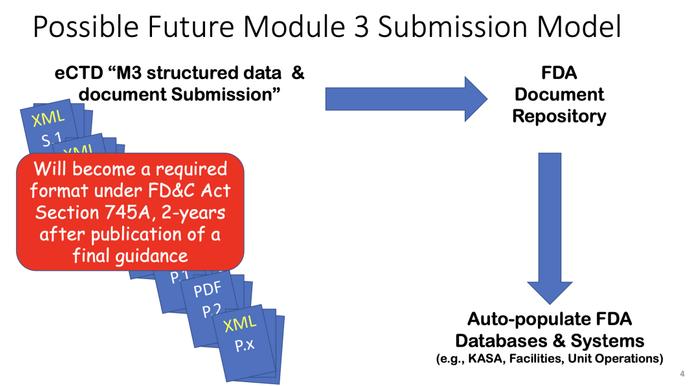
1.药品质量/药学,知识辅助评价和结构化申请(KASA)
PQ/CMC标准化和结构化eCTD提交
XML、JSON和HL7FHIR
下拉列表的受控词汇
2.知识辅助评价和结构化申请(KASA)
预填充的结构化评估
风险排名算法
预分析数据
生命周期知识管理
3.PQ/CMC的实施将通过消除手动数据输入显著增强KASA系统




1.目标:为药品信息的唯一标识和交换定义数据元素和结构
2.五个标准:
物质(ISO11238)
药物剂型、展示单位、给药途径和包装(ISO11239)
测量单位(ISO11240)
受管制药品信息(ISO11616)
受管制的医药产品信息(ISO11615)



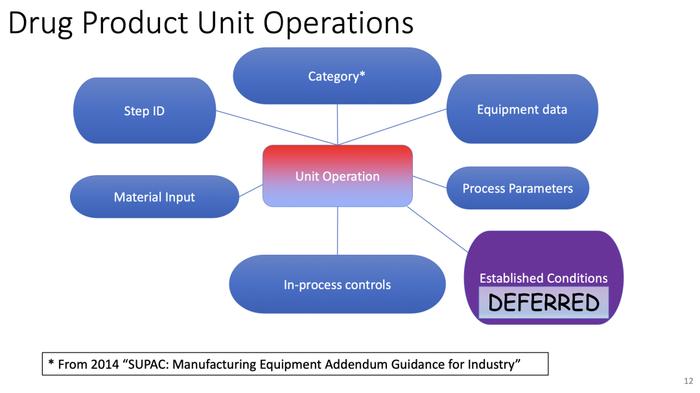



挑战
1.标准化
多元化,例如IDMP、联通、SPOR、ICH、CFR、EMA、MEDDRA、EDQM
差距,如分析程序的受控词汇(CV)、表征的化学和物理属性、规格、过程控制;IDMP代码列表
2.开发数据模型和本体
HL7FHIR供应商支持滞后,尽管得到了临床部门的大力支持供应商
FDA内部基础设施

结论
1.PQ/CMC将:
大幅改变文件提交流程
FDA和申请人需要新的业务流程和基础设施
实现与IDMP和其他产品质量工作的一致性
2.未来几年
成为745A(a)下必需提交的材料
ICH“结构化的质量文件提交”


