独家原创 | 冯令戈工程师:连续血糖监测技术在糖尿病管理中的应用与发展
转自:药学进展

冯令戈

工程师,现任华领医药技术(上海)有限公司研究与发现技术部总监。2017年毕业于美国伊利诺伊大学芝加哥分校医学与生物工程学院,负责公司创新药物研发项目的靶点验证和临床前评价,糖尿病个性化管理和诊疗的算法模型开发,以及学术合作平台管理等工作。多次参与完成国家及上海市相关科研课题工作,具有7年以上的生物医药及生物医学大数据行业项目研究经验。作为共同发明人参与了多项计算机软件著作权以及专利的撰写和申报。
连续血糖监测技术在糖尿病管理中的应用与发展 PPS
冯令戈*
(华领医药技术(上海)有限公司,上海201203)
[摘要]利用连续血糖监测(CGM)技术实时监测血糖水平,有助于更好地实现血糖管理,进行“精准控糖”。血糖目标范围内时间(TIR)作为CGM的衍生指标,成为衡量血糖控制和改善的新兴标准,并在近年逐步被纳入国内外糖尿病防控指南。TIR可以提供包括高血糖、低血糖及血糖波动在内的更全面、更细致的血糖信息,与糖化血红蛋白等传统血糖指标互为补充,更好地反映糖尿病患者血糖控制状况以及多种糖尿病并发症的疾病风险。综述CGM技术在糖尿病管理中的应用与发展,探索血糖评估新指标TIR赋能糖尿病管理的内涵和临床实用性,旨在为进一步优化糖尿病患者的血糖控制提供参考。
糖尿病是一种影响全球数亿人口的慢性代谢性疾病。最新流行病学调查显示,我国糖尿病患病率已达12.8%,糖尿病防治形势严峻[1]。血糖监测始终贯穿于糖尿病综合管理的全程中,血糖监测的结果是评估糖尿病患者血糖状态,指导生活方式干预,制定或调整降糖治疗方案的重要依据。自19世纪尿糖检测的开创性糖代谢监测方法诞生以来,血糖监测领域在过去100年里取得了重大进展,从传统的自我血糖监测(self-monitoringbloodglucose,SMBG)出现,至糖化血红蛋白(glycatedhemoglobinA1c,HbA1c),再到当下发展迅速的连续血糖监测(continuousglucosemonitoring,CGM),血糖监测技术不断向精准、便捷、微创或无创、智能化的方向发展,推动糖尿病管理效能的提升。本文就CGM技术在糖尿病管理中的应用与发展进行综述,为精准血糖管理提供科学依据。
1
血糖监测技术的发展
1.1传统血糖监测的局限性
SMBG一直是糖尿病患者日常血糖监测的主要手段,通过对餐后血糖(postprandialplasmaglucose,PPG)和空腹血糖(fastingplasmaglucose,FPG)的监测,帮助糖尿病患者进行有效的生活方式管理和药物调整,从而改善临床结局和生活质量。尽管SMBG是目前血糖监测的标准方法,但仍存在一定的局限性。重复的SMBG往往给患者带来痛苦和不便,不利于患者长期依从,且SMBG仅提供单一“时间点”的血糖数据,难以检测到隐匿性低血糖或高血糖,无法反映峰值和谷值等血糖变化的全貌和细节,不能充分有效地用于糖尿病并发症的预防和管理。此外,SMBG检测结果的准确性易受人为操作和血糖仪设备的影响,例如血糖仪或血糖试纸使用不当、仪器校准不当、血糖仪故障等[2]。
HbA1c是衡量过去8~12周平均血糖状况的常用指标,也是被公认为评价血糖控制的核心指标,可作为糖尿病诊断、并发症风险预测、降糖疗效评估的重要依据。然而,HbA1c并不能反映即刻血糖水平,也不能反映血糖波动以及实时高血糖和低血糖发生情况[3]。事实上,具有相似HbA1c水平的患者可能呈现明显不同的血糖变化模式。此外,HbA1c检测结果易受与血糖无关因素的影响,包括贫血、妊娠、血液透析、大量失血、血红蛋白异常疾病、促红细胞生成素等[2]。
1.2连续血糖监测
CGM被认为是糖尿病患者血糖控制的理想监测方式,通过动态监测皮下组织间液的葡萄糖浓度间接反映血糖水平,可提供全天血糖水平变化的完善数据参数,展现连续、全面的血糖变化图谱,发现不易被传统血糖监测方法所探测到的隐匿性高血糖和低血糖,有效覆盖SMBG和HbA1c的监测“盲区”[4]。CGM临床应用初期主要因其能够灵敏地监测低血糖发生被广泛应用于1型糖尿病(type1diabetesmellitus,T1DM)患者的血糖监控和管理中,后随着设备的更新和普及被逐渐应用于2型糖尿病(type2diabetesmellitus,T2DM)患者的血糖管理中。目前CGM共分为3类,即回顾性CGM、实时CGM(real-timeCGM,rtCGM)及扫描式CGM(intermittentlyscannedCGM,isCGM),临床医生可依据不同CGM的特点及适用人群,帮助患者选择合适的类型使用。
随着CGM技术的不断革新,新的CGM设备从精度、舒适度、传感器寿命、高/低血糖预警功能等方面均有很大改善,为糖尿病患者的血糖控制带来了灵活性和便利性,从而改善了患者满意度以及对CGM使用和药物治疗的依从性[2],同时也推动了CGM在糖尿病管理中的广泛应用,2020年CGM被美国糖尿病学会(AmericanDiabetesAssociation,ADA)推荐扩展应用于T2DM患者的血糖管理[5]。最新公布的2023版ADA《糖尿病医学诊疗标准》[6]中,CGM首次被纳入以患者为中心的血糖管理决策环,在血糖管理中的地位获得进一步提升。
2
连续血糖监测在糖尿病管理应用中的优势
CGM自问世以来积累了大量的研究数据和临床使用经验。CGM产生的血糖数据对于指导糖尿病患者平稳控糖、降低低血糖和血糖变异性、改善临床结局、提高治疗满意度等方面均存在益处。与SMBG相比,采用CGM的T1DM、T2DM患者HbA1c分别降低0.5%(P<0.001)和0.4%(P=0.02)[7-8]。Karter等[9]研究显示,采用CGM能带来更积极的HbA1c改善,血糖达标(HbA1c<7%)率可提高9.6%。在T1DM确诊后,尽早启动CGM有利于HbA1c持续改善[10]。其他临床研究也报告了类似结论,涵盖了不同的人群类别,包括从儿童到成人,从T1DM、T2DM到妊娠期糖尿病患者[11]。
CGM在降低低血糖发生率方面较SMBG更为有效,尤其对于使用胰岛素或磺脲类药物治疗致低血糖风险较高的T2DM患者[12]。多项针对rtCGM的真实世界研究表明,糖尿病患者的低血糖或严重低血糖事件显著减少[13-14]。CGM还有助于及时识别门诊无症状低血糖[15],降低院内复发性低血糖[16],减少长期低血糖的潜在危害;同时适度减少低血糖恐惧,增强降糖治疗信心,继而降低低血糖的发生风险[17]。
CGM在降低儿童、成人血糖变异性方面发挥着重要作用。近期一项针对227例T1DM儿童的多国、前瞻性、观察性、真实世界队列研究结果显示,CGM组患者的血糖变异系数(coefficientofvariation,CV)显著小于SMBG组(39.1%vs46.8%,P<0.001)[18]。另一项在T1DM学龄前儿童中开展的队列研究表明,CGM的使用与5年随访期间血糖变异性降低有关,具体表现为使用CGM期间平均血糖标准差和CV均显著减少[19]。一项涉及23个欧洲糖尿病中心的随机对照试验显示,与SMBG相比,使用CGM可显著减少T1DM成人的平均血糖波动幅度、血糖标准差、CV、低血糖指数、血糖风险指数,提示血糖变异性改善有利于糖尿病患者的整体血糖控制以及远期并发症的预防[20]。多项研究表明,应用CGM能显著降低T1DM和T2DM患者的糖尿病酮症酸中毒(diabeticketoacidosis,DKA)、高血糖高渗状态、低血糖昏迷等急性并发症的发生率[21]。一项针对7.4万例糖尿病患者的大型回顾性研究显示,启动CGM后因糖尿病急性并发症引起的住院事件发生率显著下降(T1DM、T2DM患者分别降低49.0%、39.4%),其中因低血糖昏迷至少住院1次的患者比例降低35.7%,因DKA住院的比例降幅高达50%以上[22]。此外,带警报的CGM还可以提高糖尿病患者及糖尿病患儿父母对治疗的满意度[7,23]。
自新型冠状病毒感染(coronavirusdisease2019,COVID-19)在全球范围大流行以来,糖尿病合并COVID-19患者的隔离需求给住院和门诊环境中的血糖管理带来了新的挑战。在此新形势下,CGM应用于糖尿病管理具有明显优势。据报道,COVID-19期间武汉雷神山医院建立了基于isCGM监测和云平台联网系统的血糖监测及管理新模式,实现了远程血糖管理,降低了医务人员暴露风险[24]。COVID-19疫情后,对于感染COVID-19需要居家隔离的糖尿病患者,通过CGM实施远程医疗是可行的,依然能帮助患者有效控糖[25-26]。
3
连续血糖监测作为糖尿病管理的有效工具
3.1基于连续血糖监测的血糖指标
CGM提供的丰富血糖数据催生了许多评估血糖水平的新指标,为实现全面血糖控制和优化糖尿病管理提供了重要的参考依据。2017年,国际糖尿病先进技术与治疗大会制定了CGM国际共识,首次推荐了14个参数作为CGM标准化报告中的核心指标[27]。2019年,ADA专家小组在此基础上进行简化,最终选择在临床实践中具有较大实用价值的血糖高于目标范围时间(timeaboverange,TAR)、血糖目标范围内时间(timeinrange,TIR)、血糖低于目标范围时间(timebelowrange,TBR)等10个核心CGM指标纳入指南推荐[28],并沿用至今(见表1)。
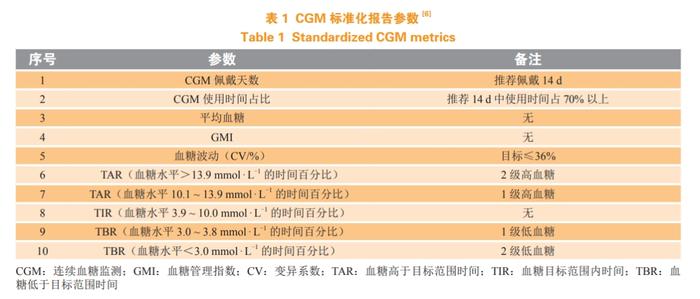
在CGM衍生的指标中,TIR由于其简单直观和可操作性,在糖尿病临床护理与治疗中具有较高的应用价值。TIR定义为24h内血糖在目标范围内(通常为3.9~10.0mmol·L-1)的时间或所占的百分比,通过反映平均血糖水平和血糖波动,实现对整体血糖控制水平的完整评价,弥补HbA1c等传统血糖监测指标的不足。2017年,CGM国际共识首次建议在临床研究中,TIR也应作为糖尿病控制的重要报告指标[27];2020年,ADA指南正式纳入TIR作为血糖控制评估指标[5];2020年版《中国2型糖尿病防治指南》、2021年ADA指南均明确推荐TIR作为糖尿病患者血糖控制目标之一[28-30]。第83届ADA年会上,来自阿姆斯特丹大学医学中心的Snethage等[31]报告了一项横断面研究成果,从病理生理学角度证实了TIR作为血糖控制指标的可靠性。该研究纳入500例T1DM患者,测量餐后尿C肽/肌酐比值(urinaryC-peptide/creatinineratios,UCPCR)作为残余β细胞功能的标志物,结果显示,较高水平的UCPCR与TIR升高显著相关(r=0.330,P<0.001),在校正性别、年龄、血糖和糖尿病病程后,该关联仍然显著,这也提示基于CGM的TIR同时能反映糖尿病患者β细胞功能状态,为临床诊疗提供更为全面的患者信息。TIR控制目标应视糖尿病患者具体情况进行个体化设定,一般推荐TIR>70%,TIR升高则意味着高/低血糖事件减少,有利于改善糖尿病相关结局。
3.2TIR的多重临床价值赋能糖尿病管理
作为一项血糖评估新指标,TIR的引入对优化糖尿病管理具有重要意义。越来越多的研究明确了TIR的应用优势,包括评估整体血糖状况,预测多种糖尿病急、慢性并发症的发生/发展风险等,为糖尿病患者临床结局和糖尿病卫生经济学成本效益的改善提供了新的视角。
3.2.1TIR与糖尿病急性并发症据报告,TIR与糖尿病患者严重低血糖事件的发生风险密切相关。一项纳入7637例T2DM患者的临床研究显示,与TIR≤50%的患者相比,TIR>70%的患者严重低血糖事件风险降低46%[32]。一项纳入515例T1DM患者的前瞻性、多中心、观察性队列研究发现,与未因低血糖或酮症酸中毒住院的患者相比,因低血糖或酮症酸中毒住院的患者TIR显著下降(63.6%±13.6%vs58.9%±11.3%,P=0.022),且TIR是T1DM患者因低血糖或酮症酸中毒住院的唯一独立危险因素,比值比(oddsratio,OR)为0.97(P=0.021)[33]。
3.2.2TIR与糖尿病血管并发症近5年的研究表明,TIR与糖尿病微血管并发症密切相关,在校正HbA1c后这一关联持续存在,表明TIR是糖尿病各种微血管并发症的独立预测因子[34]。2018年贾伟平教授团队首次应用CGM评估TIR与糖尿病视网膜病变(diabeticretinopathy,DR)的关联,发现不同分期DR患者的患病率随着TIR升高而降低(所有P趋势<0.001),校正HbA1c等混杂因素后,TIR与DR各分期仍显著相关,该研究首次证实了TIR与T2DM患者的DR患病率存在相关性,且这一关联独立于HbA1c[35]。随后,基于糖尿病控制和并发症试验(diabetescontrolandcomplicationstrial,DCCT)的数据同样证实,TIR与糖尿病微血管病变显著相关,具体表现为TIR每降低10%,DR发生风险增加64%、微量白蛋白尿发生风险增加40%[36]。相应地,随着TIR升高,微量白蛋白尿和大量白蛋白尿的患病率显著降低[37]。2020年一项随机对照试验结果表明,降糖治疗引起的TIR升高与T1DM患者白蛋白尿减少显著相关(P=0.04)[38]。ElMalahi等[33]在使用rtCGM的T1DM患者中的研究证实,TIR是复合微血管并发症的独立危险因素(OR=0.97,P=0.005)。2023年ADA年会报道,TIR与糖尿病微血管并发症发生风险的负性关联在一项长达7年的纵向研究中获得进一步验证[39]。
TIR与糖尿病大血管并发症之间相关性的研究较少。一项研究采用横断面分析了2215例T2DM患者,基于CGM得到的TIR数据显示,颈动脉内膜中层厚度(carotidintima-mediathickness,CIMT)异常患者的TIR水平显著低于CIMT正常者,TIR每升高10%,CIMT异常风险降低6.4%,且TIR和CIMT之间的关联与微血管并发症的状态(DR或白蛋白尿)无关,表明TIR与糖尿病大血管并发症相关[40]。
此外,有研究发现,TIR与T2DM患者下肢动脉粥样硬化疾病(lowerextremityatheroscleroticdisease,LEAD)风险呈负相关,TIR每降低10%,LEAD事件或进展性LEAD的发生风险增加7%[41]。
3.2.3TIR与糖尿病神经病变多项研究发现,TIR与糖尿病周围或中枢神经病变相关。一项纳入105例T2DM患者的前瞻性、观察性队列研究显示,TIR越低,糖尿病周围神经病变(diabeticperipheralneuropathy,DPN)的发生率越高,TIR每降低10%,DPN的发生风险增加25%[42]。另一项在740例T2DM患者中开展的横断面研究,根据TIR将患者分为低TIR(≤53%)、中等TIR(54%~76%)和高TIR(≥77%)3组,评估TIR与神经传导参数(神经传导速度、波幅、潜伏期)之间的相关性发现,随着TIR增加,神经传导速度和振幅的复合Z分数显著升高,潜伏期的复合Z分数显著降低,校正混杂因素后,TIR较高与周围神经功能较好独立相关,提示TIR可能作为筛选DPN高危人群的一种潜在标志物[43]。此外,TIR降低与DPN患者的多种疼痛、中度/重度疼痛的风险增加显著相关(P<0.05)[44]。应用CGM评估TIR与T2DM患者心脏自主神经病变(cardiovascularautonomicneuropathy,CAN)之间的相关性研究显示,随着TIR升高,伴有CAN或严重CAN的患者比例显著降低[45]。
3.2.4TIR与其他临床结局一项针对6225例中国T2DM患者的前瞻性队列研究显示,中位随访6.9年,随着TIR降低,全因死亡风险(P趋势<0.001)和心血管疾病死亡风险(P趋势=0.015)均显著升高,与TIR>85%的患者相比,TIR≤50%的患者全因死亡和心血管疾病死亡风险分别增加83%、85%[46]。在妊娠糖尿病患者中,与TIR≤70%的患者相比,TIR>70%患者的新生儿重症监护室住院风险(P=0.035)和呼吸窘迫综合征风险(P=0.012)显著更低,住院时间显著更短(P=0.012),产妇发展为高血压疾病的风险(P=0.04)和重度先兆子痫的风险(P=0.04)也显著更低[47]。此外,与TIR>70%的T2DM患者相比,TIR≤70%的T2DM患者癌症死亡风险增加32%,TIR每降低10%,癌症死亡风险增加7%[48]。
3.2.5TIR的成本效益以TIR作为糖尿病血糖管理指标具有成本效益,从长远来看可减轻患者医疗负担。研究发现,将TIR从≤50%增加到51%~70%、71%~85%和>85%,质量调整生命年(quality[1]adjustedlifeyears,QALYs)也随之增加,分别增加至1.12、1.39和2.53[49]。据IQVIA关于TIR的白皮书报告,在美国T1DM和T2DM患者中,如果平均TIR达到70%甚至80%,估计10年内医疗成本可节约21亿~97亿美元[50]。该报告还指出,对于T2DM患者,血糖越高,改善TIR所带来的成本收益越大。基线HbA1c<7%的患者TIR升高5%,估计10年内每人可节约成本20美元,而基线HbA1c>8%的患者TIR升高5%,估计10年内每人可节约成本1470美元,相差近74倍。因此,TIR监测及基于TIR的临床干预措施可能更适用于血糖控制不佳的糖尿病患者,兼具健康获益和成本效益。
3.3临床常用降糖药物对TIR的改善
TIR逐渐成为临床中用来评价血糖控制情况的核心参数,在降糖药物疗效评估方面,TIR显示出临床应用优势,越来越多的降糖药物研究人员开始关注TIR的改善,以评估其在血糖波动及低血糖发生风险方面的改善,并结合传统血糖检测指标全面展现其特点。新近公布的多项临床研究应用CGM进行血糖监测,结果表明,双胍类、α-糖苷酶抑制剂、二肽基肽酶-4抑制剂、钠-葡萄糖协同转运蛋白2抑制剂等常见口服降糖药物能显著提高TIR,在一定程度上改善了血糖波动,延长血糖达标时间至或接近70%[51-54]。可以预见,以TIR作为降糖药物疗效评估指标,将进一步优化当前以HbA1c为主和简单针对控制FPG和PPG的评估体系,为糖尿病患者血糖精细化管理提供更为完善的信息。
4
大数据分析和人工智能助推TIR应用于糖尿病管理
4.1TIR广泛应用的挑战
CGM是TIR数据获取最直接途径,但由于CGM结果解读往往需要专业支持,且价格昂贵,操作相对传统血糖监测设备繁琐,在临床试验中也受多因素限制,CGM设备临床实践应用有限。长期的CGM设备佩戴会直接影响试验方案设计,进而为临床研究的结果带来诸多不确定性,且在大型临床研究中佩戴设备的时间会直接影响研究的成本和数据的准确度,而不同研究间不同CGM使用设备和型号的差异也往往使得结果难以横向对比。尽管CGM被临床专家作为更加精准的血糖监测手段所推荐,但CGM设备在经济欠发达地区和临床研究中的应用仍将面临许多挑战,这也是广泛采用TIR作为代表血糖控制指标的主要障碍。美国真实世界T1DExchange研究最新登记注册数据显示,截至2022年仍有47%的T1DM患者未使用CGM[55]。鉴于此,目前不少研究者转而探索TIR与各种临床生物标志物相关数据的关系,试图在CGM数据不可及时,通过新的模型和算法技术推断TIR值。
4.2TIR与HbA1c的相关性
TIR与HbA1c具有良好的相关性。研究发现,TIR70%对应的HbA1c为7%[56]。Beck等[57]在T1DM患者中评估TIR与HbA1c的相关性发现,TIR每升高10%,HbA1c下降约0.5%。针对T1DM和T2DM患者18项研究的分析显示,TIR与HbA1c具有明确的对应关系,两者之间存在显著的线性负相关(R=-0.84;R2=0.71),线性方程为TIR=-12.762×HbA1c+155.4,TIR每升高10%,HbA1c下降0.8%[58]。尽管基于此线性关联可以实现HbA1c与TIR的转换,从而在TIR不可及时估算TIR值,但该转换关系的科学可解释性、实用性和准确性还有待验证。
4.3TIR与FPG、PPG的相关性
FPG和PPG控制同样影响TIR水平。Liao等[59]汇总了1572例接受胰岛素治疗的T2DM患者数据,评估TIR与FPG、PPG的相关性发现,FPG每降低1mmol·L-1,TIR升高6.5%(P<0.0001);PPG每降低1mmol·L-1,TIR升高5.3%(P<0.0001)。TIR相较于基线变化的敏感性分析显示,FPG和PPG每降低1mmol·L-1,TIR升高更多,分别达7.1%、6.6%,表明FPG和PPG与TIR存在显著相关性。该研究结果证明了采用FPG和PPG估算TIR值的潜力,但尚需证据支持。
4.4TIR预测模型
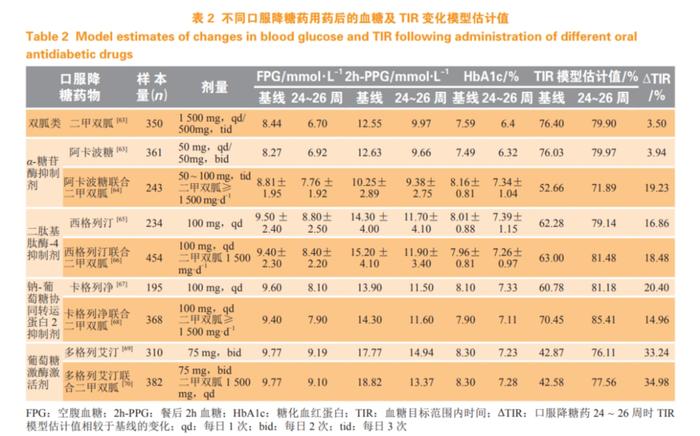
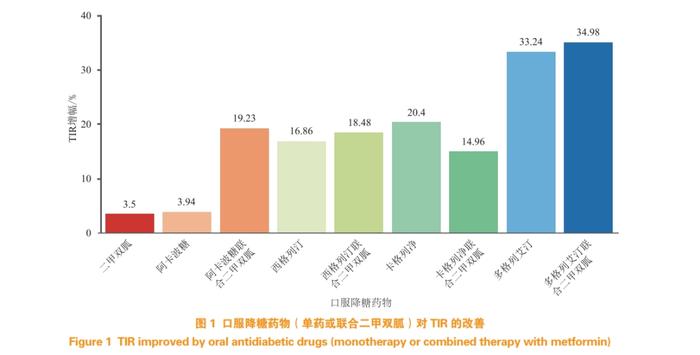
TIR作为具有反映血糖波动状态和平均血糖变化的复合指标,能够反映SMBG中的点血糖和HbA1c中所包含的信息。仅从HbA1c、FPG、PPG等单一血糖值预估TIR的方法往往因其数据和信息维度的局限性而难以有效和准确地估计或预测TIR。因此研究人员越来越多的趋向于考虑纳入多种不同维度的血糖指标及其组合的线性或非线性回归模型对TIR进行探索性估计。Desouza等[60]在一项24周内评估TIR与4种SMBG血糖检测值(糖化白蛋白、果糖胺、平均血糖和HbA1c)之间Pearson线性相关性的研究结果显示,糖化白蛋白是短期估算TIR的有效因子,可弥补仅使用HbA1c测量的2~3个月血糖水平与CGM或SMBG提供的每日信息之间的差距。近期Sun等[61]和Ma等[62]建立的TIR预测模型在2023年ADA年会上引起了很大关注,该模型揭示了多变量机器学习模型在TIR估算上的可行性,模型通过中国T2DM人群的3个临床常见的血糖检测值(HbA1c、FPG、PPG)以及随机森林算法构建了对TIR值的计算模型,并揭示了在不同人群中TIR与这些传统血糖检测值的非线性关系。同时,该模型的应用使得不同临床研究可以产生在同一环境下的TIR值和横向比对,在一定程度上解决了因不同的CGM设备带来的TIR不稳定的问题。表2列举了目前临床常见口服降糖药在Ⅲ期注册临床研究中患者治疗前后的FPG、PPG及HbA1c数值变化[63-70]。由上述参数计算出的TIR值显示FPG、PPG和HbA1c的非线性关系,以及药物治疗带来的TIR改善程度(ΔTIR,见图1)与PPG基线指标密切相关,提示在T2DM患者中控制餐后高血糖对血糖波动改善的重要意义。
5
结语与展望
血糖监测对于糖尿病及其并发症的管理具有重要的作用,集无创、便捷、准确等多重优势于一体的CGM必将与SMBG、HbA1c一起成为糖尿病综合管理全程中的血糖监测手段。TIR作为血糖评估新指标,可以提供更多血糖控制质量的信息,与低血糖发生、血管并发症、神经病变及死亡等糖尿病相关不良预后密切相关,监测TIR不仅可以改善糖尿病患者临床结局,还兼具成本效益的优化。以临床大数据为依托的TIR计算技术会在临床应用中不断优化,与传统血糖监测指标互为补充,形成覆盖“点(HbA1c)、线(SMBG)、面(CGM)”不同维度的全方位血糖监测体系,促进糖尿病患者个性化和远程化血糖管理。
参考文献:
[1]LiY,TengD,ShiX,etal.Prevalenceofdiabetesrecordedin Chinausing2018diagnosticcriteriafromtheAmericanDiabetesAssociation:nationalcrosssectionalstudy[J].BMJ,2020,369:m997.DOI:10.1136/bmj.m997.
[2]UngerJ.Continuousglucosemonitoringoverview:featuresandevidence[J].AmJManagCare,2022,28(Suppl4):S60-S68.
[3]AjjanR,SlatteryD,WrightE.Continuousglucosemonitoring:abriefreviewforprimarycarepractitioners[J].AdvTher,2019,36(3):579-596.
[4] 中华医学会糖尿病学分会.中国血糖监测临床应用指南(2021年版)[J].中华糖尿病杂志,2021,13(10):936-948.
[5]AmericanDiabetesAssociation.Standardsofmedicalcareindiabetes-2020[J].DiabetesCare,2020,43(Suppl1):S1-S212.
[6]AmericanDiabetesAssociation.Standardsofcareindiabetes[1]2023[J].DiabetesCare,2023,46(Suppl1):S1-S291.
[7]LeelarathnaL,EvansML,NeupaneS,etal.Intermittentlyscannedcontinuousglucosemonitoringfortype1diabetes[J].NEnglJMed,2022,387(16):1477-1487.
[8]MartensT,BeckRW,BaileyR,etal.Effectofcontinuousglucosemonitoringonglycemiccontrolinpatientswithtype2diabetestreatedwithbasalinsulin:arandomizedclinicaltrial[J].JAMA,2021,325(22):2262-2272.
[9]KarterAJ,ParkerMM,MoffetHH,etal.Associationofreal-timecontinuousglucosemonitoringwithglycemiccontrolandacutemetaboliceventsamongpatientswithinsulin-treateddiabetes[J].JAMA,2021,325(22):2273-2284.
[10]ChampakanathA,AkturkHK,AlonsoGT,etal.Continuousglucosemonitoringinitiationwithinfirstyearoftype1diabetesdiagnosisisassociatedwithimprovedglycemicoutcomes:7-yearfollow-upstudy[J].DiabetesCare,2022,45(3):750-753.
[11]CapponG,VettorettiM,SparacinoG,etal.Continuousglucosemonitoringsensorsfordiabetesmanagement:areviewoftechnologiesandapplications[J].DiabetesMetabJ,2019,43(4):383-397.
[12]BergenstalRM,MullenDM,StrockE,etal.Randomizedcomparisonofself-monitoredbloodglucose(BGM)versuscontinuousglucosemonitoring(CGM)datatooptimizeglucosecontrolintype2diabetes[J].JDiabetesComplications,2022,36(3):108106.DOI:10.1016/j.jdiacomp.2021.108106.
[13]KantR,AntonyMA,GeurkinkD,etal.Real-timecontinuousglucosemonitoringimprovesglycemiccontrolandreduceshypoglycemia:real-worlddata[J].PrimCareDiabetes,2022,16(6):786-790.
[14]JensenMH,VestergaardP,HirschIB,etal.Useofpersonalcontinuousglucosemonitoringdeviceisassociatedwithreducedriskofhypoglycemiaina16-weekclinicaltrialofpeoplewithtype1diabetesusingcontinuoussubcutaneousinsulininfusion[J].JDiabetesSciTechnol,2022,16(1):106-112.
[15]HuangB,JiangQ,WuT,etal.Hypoglycemiaunawarenessidentifiedbycontinuousglucosemonitoringsystemisfrequentinoutpatientswithtype2diabeteswithoutreceivingintensivetherapeuticinterventions[J].DiabetolMetabSyndr,2022,14(1):180.DOI:10.1186/s13098-022-00959-x.
[16]SpanakisEK,UrrutiaA,GalindoRJ,etal.Continuousglucosemonitoring-guidedinsulinadministrationinhospitalizedpatientswithdiabetes:arandomizedclinicaltrial[J].DiabetesCare,2022,45(10):2369-2375.
[17]NgSM,MooreHS,ClementeMF,etal.Continuousglucosemonitoringinchildrenwithtype1diabetesimproveswell-being,alleviatesworryandfearofhypoglycemia[J].DiabetesTechnolTher,2019,21(3):133-137.
[18]DovcK,vanNameM,JenkoBizjanB,etal.Continuousglucosemonitoringuseandglucosevariabilityinveryyoungchildrenwithtype1diabetes(VibRate):amultinationalprospectiveobservationalreal-worldcohortstudy[J].DiabetesObesMetab,2022,24(3):564-569.
[19]BolinderJ,AntunaR,Geelhoed-DuijvestijnP,etal.Novelglucose[1]sensingtechnologyandhypoglycaemiaintype1diabetes:amulticentre,non-masked,randomisedcontrolledtrial[J].Lancet,2016,388(10057):2254-2263.
[20]DovcK,CargneluttiK,SturmA,etal.Continuousglucosemonitoringuseandglucosevariabilityinpre-schoolchildrenwithtype1diabetes[J].DiabetesResClinPract,2019,147:76-80.DOI:10.1016/j.diabres.2018.10.005.
[21]GavinJR,BaileyCJ.Real-worldstudiessupportuseofcontinuousglucosemonitoringintype1andtype2diabetesindependentlyoftreatmentregimen[J].DiabetesTechnolTher,2021,23(S3):S19-S27.
[22]RousselR,RivelineJP,VicautE,etal.Importantdropinrateofacutediabetescomplicationsinpeoplewithtype1ortype2diabetesafterinitiationofflashglucosemonitoringinFrance:theRELIEFstudy[J].DiabetesCare,2021,44(6):1368-1376.
[23]BurckhardtMA,AbrahamMB,MountainJ,etal.Improvementinpsychosocialoutcomesinchildrenwithtype1diabetesandtheirparentsfollowingsubsidyforcontinuousglucosemonitoring[J].DiabetesTechnolTher,2019,21(10):575-580.
[24]ShenY,FanX,ZhangL,etal.ThresholdsofglycemiaandtheoutcomesofCOVID-19complicatedwithdiabetes:aretrospectiveexploratorystudyusingcontinuousglucosemonitoring[J].DiabetesCare,2021,44(4):976-982.
[25]KaushalT,TinsleyL,VolkeningLK,etal.ImprovementinmeanCGMglucoseinyoungpeoplewithtype1diabetesduring1yearoftheCOVID-19pandemic[J].DiabetesTechnolTher,2022,24(2):136-139.
[26]KaushalT,TinsleyLJ,VolkeningLK,etal.ImprovedCGMglucometricsandmorevisitsforpediatrictype1diabetesusingtelemedicineduring1yearofCOVID-19[J].JClinEndocrinolMetab,2022,107(10):e4197-e4202.
[27]DanneT,NimriR,BattelinoT,etal.Internationalconsensusonuseofcontinuousglucosemonitoring[J].DiabeteCare,2017,40(12):1631-1640.
[28]AmericanDiabetesAssociation.Standardsofmedicalcareindiabetes-2019[J].DiabetesCare,2019,42(Suppl1):S1-S193.
[29]AmericanDiabetesAssociation.Standardsofmedicalcareindiabetes-2021[J].DiabetesCare,2021,44(Suppl1):S1-S232.
[30] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2020年版)[J].中华糖尿病杂志,2021,13(4):315-409.
[31]SnethageCF,McdonaldTJ,RampanelliE,etal.Associateswithlowerglycaemicvariabilityandmoretimeinrangeinindividualswithtype1diabetes[J].Diabetes,2023,72(Suppl1):27-OR.DOI:10.2337/db23-27-OR.
[32]BergenstalR,KvistK,HachmannNE,etal.Derivedtime-in-rangeisassociatedwithMACEintype2diabetes:datafromtheDEVOTEtrial[J].Diabetes,2020,69(Suppl1):21-LB.DOI:10.2337/db20-21-LB.
[33]ElMalahiA,vanElsenM,CharleerS,etal.Relationshipbetweentimeinrange,glycemicvariability,HbA1candcomplicationsinadultswithtype1diabetesmellitus[J].JClinEndocrinolMetab,2022,107(2):e570-e581.
[34]YooJH,KimJY,KimJH.Associationbetweencontinuousglucosemonitoring-derivedglycemiariskindexandalbuminuriaintype2diabetes[J].DiabetesTechnolTher,2023.DOI:10.1089/dia.2023.0165.
[35]LuJ,MaX,ZhouJ,etal.Associationoftimeinrange,asassessedbycontinuousglucosemonitoring,withdiabeticretinopathyintype2diabetes[J].DiabetesCare,2018,41(11):2370-2376.
[36]BeckRW,BergenstalRM,RiddlesworthTD,etal.Validationoftimeinrangeasanoutcomemeasurefordiabetesclinicaltrials[J].DiabetesCare,2019,42(3):400-405.
[37]ChaiS,WuS,XinS,etal.Negativeassociationoftimeinrangeandurinaryalbuminexcretionrateinpatientswithtype2diabetesmellitus:aretrospectivestudyofinpatients[J].ChinMedJ(Engl),2022,135(9):1052-1056.
[38]RanjanAG,RosenlundSV,HansenTW,etal.Improvedtimeinrangeover1yearisassociatedwithreducedalbuminuriainindividualswithsensor-augmentedinsulinpump-treatedtype1diabetes[J].DiabetesCare,2020,43(11):2882-2885.
[39]ShahVN,SakamotoC,PyleL,etal.Timeinrangeisassociatedwithincidentdiabeticretinopathyinadultswithtype1diabetes-aseven[1]yearlongitudinalstudy[J].Diabetes,2023,72(Suppl1):226-OR.DOI:10.2337/db23-226-OR.
[40]LuJ,MaX,ShenY,etal.Timeinrangeisassociatedwithcarotidintima-mediathicknessintype2diabetes[J].DiabetesTechnolTher,2020,22(2):72-78.
[41]WangY,LuJ,ShenY,etal.Associationoftimeinrangewithlowerextremityatheroscleroticdiseaseintype2diabetesmellitus:aprospectivecohortstudy[J].Endocrine,2022,76(3):593-600.
[42]MayedaL,KatzR,AhmadI,etal.Glucosetimeinrangeandperipheralneuropathyintype2diabetesmellitusandchronickidneydisease[J].BMJOpenDiabetesResCare,2020,8(1):e000991.DOI:10.1136/bmjdrc-2019-000991.
[43]LiF,ZhangY,LiH,etal.TIRgeneratedbycontinuousglucosemonitoringisassociatedwithperipheralnervefunctionintype2diabetes[J].DiabetesResClinPract,2020,166:108289.DOI:10.1016/j.diabres.2020.108289.
[44]YangJ,YangX,ZhaoD,etal.Associationoftimeinrange,asassessedbycontinuousglucosemonitoring,withpainfuldiabeticpolyneuropathy[J].JDiabetesInvestig,2021,12(5):828-836.
[45]GuoQ,ZangP,XuS,etal.Timeinrange,asanovelmetricofglycemiccontrol,isreverselyassociatedwithpresenceofdiabeticcardiovascularautonomicneuropathyindependentofHbA1cinChinesetype2diabetes[J].JDiabetesRes,2020,2020:5817074.DOI:10.1155/2020/5817074.
[46]LuJ,WangC,ShenY,etal.Timeinrangeinrelationtoall-causeandcardiovascularmortalityinpatientswithtype2diabetes:aprospectivecohortstudy[J].DiabetesCare,2021,44(2):549-555.
[47]FishelBartalM,AshbyCornthwaiteJA,GhafirD,etal.Timeinrangeandpregnancyoutcomesinpeoplewithdiabetesusingcontinuousglucosemonitoring[J].AmJPerinatol,2023,40(5):461-466.
[48]ShenY,WangC,WangY,etal.Associationbetweentimeinrangeandcancermortalityamongpatientswithtype2diabetes:aprospectivecohortstudy[J].ChinMedJ(Engl),2021,135(3):288-294.
[49]AlkhuzamK,ShiL,FonsecaV,etal.Long-termhealthbenefitandeconomicreturnoftimeinrange(TIR)improvementinindividualswithtype2diabetes[J].Diabetes,2022,71(Suppl1):659-P.DOI:10.2337/db22-659-P.
[50]CaiA,BrownA,CloseK.IQVIAWhitepaperontimeinrange:improvingUSdiabetespopulationTIRto70%couldsaveatleast$2-$4billionovertenyears-November7,2019[EB/OL].(2019-11-07)[2023-06-01].https://www.managedcarecgm.com/wp-content/uploads/2020/01/IQVIA-White-Paper-on-Time-in-Range.pdf.
[51]PanJ,XuY,ChenS,etal.TheeffectivenessoftraditionalChinesemedicineJinlidagranulesonglycemicvariabilityinnewlydiagnosedtype2diabetes:adouble-blinded,randomizedtrial[J].JDiabetesRes,2021,2021:6303063.DOI:10.1155/2021/6303063.
[52]ViannaAGD,LacerdaCS,PechmannLM,etal.Improvedglycaemicvariabilityandtimeinrangewithdapagliflozinversusgliclazidemodifiedreleaseamongadultswithtype2diabetes,evaluatedbycontinuousglucosemonitoring:a12-weekrandomizedcontrolledtrial[J].DiabetesObesMetab,2020,22(4):501-511.
[53]GaoF,MaX,PengJ,etal.Theeffectofacarboseonglycemicvariabilityinpatientswithtype2diabetesmellitususingpremixedinsulincomparedtometformin(AIM):anopen-labelrandomizedtrial[J].DiabetesTechnolTher,2020,22(4):256-264.
[54]TakumaK,FuchigamiA,ShigiyamaF,etal.ComparisonoftheeffectsofsitagliptinanddapagliflozinontimeinrangeinJapanesepatientswithtype2diabetesstratifiedbybodymassindex:asub[1]analysisoftheDIVERSITY-CVRstudy[J].DiabetesObesMetab,2023,25(8):2131-2141.
[55]EbekozienO,NoorN,DimeglioL,etal.2022stateoftype1diabetesintheU.S.-realworldT1Dexchangemulticenterdatafromover60,000people[J].Diabetes,2023,72(Suppl1):1456-P.DOI:10.2337/db23-1456-P.
[56]BattelinoT,DanneT,BergenstalRM,etal.Clinicaltargetsforcontinuousglucosemonitoringdatainterpretation:recommendationsfromtheinternationalconsensusontimeinrange[J].DiabetesCare,2019,42(8):1593-1603.
[57]BeckRW,BergenstalRM,ChengP,etal.Therelationshipsbetweentimeinrange,hyperglycemiametrics,andHbA1c[J].JDiabetesSciTechnol,2019,13(4):614-626.
[58]VigerskyRA,McMahonC.TherelationshipofhemoglobinA1Ctotime-in-rangeinpatientswithdiabetes[J].DiabetesTechnolTher,2019,21(2):81-85.
[59]LiaoB,ChenY,ChigutsaF,etal.Fastingandpostprandialplasmaglucosecontributiontoglycatedhaemoglobinandtimeinrangeinpeoplewithtype2diabetesonbasalandbolusinsulintherapy:resultsfromapooledanalysisofinsulinlisproclinicaltrials[J].DiabetesObesMetab,2021,23(7):1571-1579.
[60]DesouzaCV,RosenstockJ,KohzumaT,etal.Glycatedalbumincorrelateswithtime-in-rangebetterthanHbA1corfructosamine[J].JClinEndocrinolMetab,2023:dgad298.DOI:10.1210/clinem/dgad298.
[61]SunR,DuanY,ZhangY,etal.Timeinrangeestimationinpatientswithtype2diabetesisimprovedbyincorporatingfastingandpostprandialglucoselevels[J].DiabetesTher,2023,14(8):1373-1386.
[62]MaJH,SuXF,FengLG,etal.Accessingglucosefluctuation-theroleofFPG,PPG,andHbA1c[J].Diabetes,2023,72(Suppl1):128-LB.DOI:10.2337/db23-128-LB.
[63]YangW,LiuJ,ShanZ,etal.Acarbosecomparedwithmetforminasinitialtherapyinpatientswithnewlydiagnosedtype2diabetes:anopen-label,non-inferiorityrandomisedtrial[J].LancetDiabetesEndocrinol,2014,2(1):46-55.
[64]DuJ,LiangL,FangH,etal.EfficacyandsafetyofsaxagliptincomparedwithacarboseinChinesepatientswithtype2diabetesmellitusuncontrolledonmetforminmonotherapy:resultsofaphaseIVopen-labelrandomizedcontrolledstudy(theSMARTstudy)[J].DiabetesObesMetab,2017,19(11):1513-1520.
[65]AschnerP,KipnesMS,LuncefordJK,etal.Effectofthedipeptidylpeptidase-4inhibitorsitagliptinasmonotherapyonglycemiccontrolinpatientswithtype2diabetes[J].DiabetesCare,2006,29(12):2632-2637.
[66]CharbonnelB,KarasikA,LiuJ,etal.Efficacyandsafetyofthedipeptidylpeptidase-4inhibitorsitagliptinaddedtoongoingmetformintherapyinpatientswithtype2diabetesinadequatelycontrolledwithmetforminalone[J].DiabetesCare,2006,29(12):2638-2643.
[67]StenlöfK,CefaluWT,KimKA,etal.Efficacyandsafetyofcanagliflozinmonotherapyinsubjectswithtype2diabetesmellitusinadequatelycontrolledwithdietandexercise[J].DiabetesObesMetab,2013,15(4):372-382.
[68]Lavalle-GonzálezFJ,JanuszewiczA,DavidsonJ,etal.Efficacyandsafetyofcanagliflozincomparedwithplaceboandsitagliptininpatientswithtype2diabetesonbackgroundmetforminmonotherapy:arandomisedtrial[J].Diabetologia,2013,56(12):2582-2592.
[69]ZhuD,LiX,MaJ,etal.Dorzagliatinindrug-naïvepatientswithtype2diabetes:arandomized,double-blind,placebo-controlledphase3trial[J].NatMed,2022,28(5):965-973.
[70]YangW,ZhuD,GanS,etal.Dorzagliatinadd-ontherapytometformininpatientswithtype2diabetes:arandomized,double-blind,placebo[1]controlledphase3trial[J].NatMed,2022,28(5):974-981.
美编排版:陈鑫茹
感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2023年第10期。
