速递!武田/大冢制药Bcr-Abl抑制剂在中国申报上市
转自:医药观澜
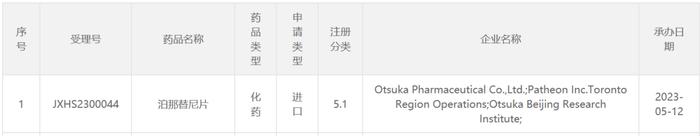
今日(5月12日),中国国家药监局药品审评中心(CDE)最新公示,由大冢制药(Otsuka)申请的泊那替尼片上市申请已获受理。不久前,该产品已被CDE纳入优先审评,拟定适应症包括:1)对既往用药耐药或不耐受的慢性髓性白血病(CML);2)复发或难治性费城染色体阳性急性淋巴细胞白血病(Ph+ALL);3)T315I阳性CML或T315I阳性Ph+ALL。另外,泊那替尼还曾被纳入第一批临床急需境外新药名单。
公开资料显示,泊那替尼片(ponatinib,英文商品名为Iclusig)是一款第三代Bcr-Abl激酶抑制剂。它能够靶向Bcr-Abl原型,以及所有已知的单一、治疗耐药性突变,包含最常见的T315I突变型。泊那替尼对T315I突变型Bcr-Abl激酶具有高效特异性抑制作用,可有效解决现有Bcr-Abl抑制剂普遍存在、因激酶突变引起耐药性的缺陷。目前,该药已在海外获批用于不同分期的CML患者和Ph+ALL患者。
泊那替尼的主要靶点Bcr-Abl是CML和Ph+ALL这两个瘤种均表达的一种异常酪氨酸激酶。由Bcr-Abl基因表达的癌蛋白是慢性粒细胞白血病的病理学基础。值得注意的是,Ph+ALL也是造成CML的主要原因。

泊那替尼最初由AriadPharmaceuticals研发。2014年12月,大冢制药与Ariad公司达成合作,获得了在日本、中国、韩国等亚洲国家共同开发和商业化泊那替尼的权利。2017年初,武田通过收购Ariad公司获得了这款产品。
根据中国药物临床试验登记与信息公示平台,目前泊那替尼正在开展多项临床试验,包括:比较泊那替尼和伊马替尼联合强度降低的化疗用于新诊断为Ph+ALL患者的3期研究;泊那替尼对TKI治疗失败或T315I突变的CML或Ph+ALL患者的2期临床试验;评价泊那替尼联合化疗治疗既往含酪氨酸激酶抑制剂治疗后复发或耐药或不耐受,或T315I突变的Ph+ALL儿童患者的安全性和疗效的关键性1/2期、单臂、开放研究等。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网.RetrievedMay 12,2023,fromhttps://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
[2]PonatinibefficacyandsafetyinPhiladelphiachromosome-positiveleukemia:final5-yearresultsofthephase2PACEtrial.Blood2018Mar22
[3] OtsukaandARIADAnnounceNewDrugApplicationforPonatinibSubmittedinJapanfortheTreatmentofRefractoryLeukemia.Retrieved Jan19,2016.fromhttps://www.fiercepharma.com/pharma-asia/otsuka-and-ariad-announce-new-drug-application-for-ponatinib-submitted-japan-for
