君实生物PD-1单抗一线治疗新进展:1获批1计划递交上市
转自:一度医药
刚刚,据中国国家药监局(NMPA)官网最新公示,君实生物抗PD-1单抗药物特瑞普利单抗的一项新适应症申请已获得批准上市。

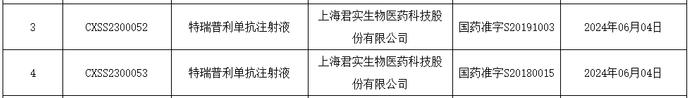
根据君实生物早先新闻稿,该药本次获批的适应症为:联合依托泊苷和铂类用于广泛期小细胞肺癌(ES-SCLC)一线治疗。这是特瑞普利单抗获批的第9项适应症。
上市主要基于EXTENTORCH研究(NCT04012606),是一项随机、双盲、安慰剂对照、多中心的3期临床研究,旨在比较特瑞普利单抗或安慰剂联合依托泊苷及铂类在一线治疗ES-SCLC的有效性和安全性。
结果显示,相比单纯化疗,特瑞普利单抗联合化疗一线治疗ES-SCLC可显著延长患者的PFS和OS。特瑞普利单抗安全性数据与既往研究相似,未发现新的安全性信号。特瑞普利单抗成为全球首个在ES-SCLC一线治疗3期研究中达成总生存期(OS)和无进展生存期(PFS)双重主要终点的PD-1抑制剂:
最终PFS分析(中位随访时间为11.8个月)显示,与单纯化疗相比,特瑞普利单抗联合化疗显著改善患者PFS(研究者评估的中位PFS为5.8个月vs.5.6个月),疾病进展或死亡风险降低33.3%。
最终OS分析(中位随访时间为13.7个月)显示,与单纯化疗相比,特瑞普利单抗联合化疗生存获益显著(中位OS为14.6个月vs.13.3个月),死亡风险降低了20.2%。
生物标志物探索分析发现,无论肿瘤突变负荷(TMB)状态如何,特瑞普利单抗联合化疗组的PFS和OS均有改善。此外,黏着斑/整合素信号通路突变与特瑞普利单抗联合化疗患者PFS和OS不良预后相关。此外,安全性良好,未发现新的安全性信号。
值得一提的是,昨日晚间君实生物还公布了特瑞普利单抗联合贝伐珠单抗一线治疗晚期肝细胞癌(HCC)的3期临床研究(HEPATORCH研究)结果,达到PFS和OS双终点,并计划将于近期向监管部门递交该新适应症的上市申请。
HEPATORCH研究是一项多中心、随机、开放、阳性药对照的3期临床研究,旨在评估与标准治疗索拉非尼相比,特瑞普利单抗联合贝伐珠单抗一线治疗不可切除或转移性HCC的有效性和安全性。
研究结果显示,特瑞普利单抗联合贝伐珠单抗一线治疗晚期HCC患者,相较于索拉非尼,可显著延长患者的PFS和OS,同时改善客观缓解率和至疾病进展时间等次要终点。特瑞普利单抗安全性数据与已知风险相符,未发现新的安全性信号。关于详细的研究数据,君实生物将在近期国际学术大会上公布。
作为国内首个PD-1单抗,特瑞普利单抗于2018年12月首次在中国内地获批上市,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。
截止目前,特瑞普利单抗适应症已获批9项适应症,包括鼻咽癌、尿路上皮癌、食管鳞状细胞癌、非小细胞肺癌和肾细胞癌,以及今日获批的一线治疗小细胞肺癌适应症。
其中,肾细胞癌是特瑞普利单抗刚刚获批的第8项适应症,于今年4月获批,联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗,这也是我国首个获批的肾癌免疫疗法。
而特瑞普利单抗的出海工作也在稳步进行中,并于去年10月作为首款鼻咽癌药物在美国获得批准。
据君实生物2023年年度报告及2024年一季报:2023年,特瑞普利单抗销售收入9.19亿元,同比增长约24.93%。2024年第一季度于国内市场实现销售收入约3.07亿元,同比增长约56.82%。
君实生物已在全球开展了40多项特瑞普利单抗临床研究,涵盖超过15种适应症,包括中国、美国、东南亚和欧洲。正在进行或已完成的评估特瑞普利单抗安全性和疗效的关键临床试验涵盖多种肿瘤类型,包括肺癌、鼻咽癌、食道癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌和皮肤癌。
