默沙东HIF-2α抑制剂拟纳入优先审评,针对肾细胞癌等
转自:医药观澜
▎药明康德内容团队编辑
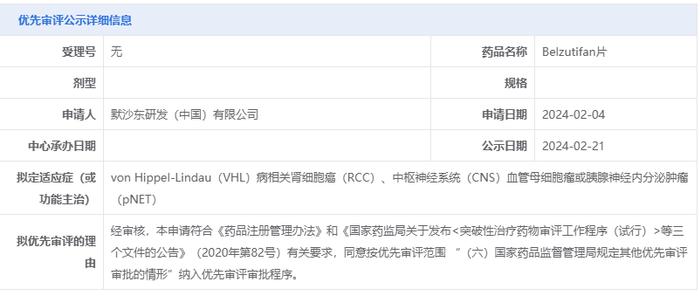
2月21日,中国国家药监局药品审评中心(CDE)官网公示,默沙东(MSD)递交的belzutifan片拟被纳入优先审评,针对的适应症为vonHippel-Lindau(VHL)病相关肾细胞癌(RCC)、中枢神经系统(CNS)血管母细胞瘤或胰腺神经内分泌肿瘤(pNET)。公开资料显示,belzutifan是一种HIF-2α抑制剂,此前已在美国、英国、加拿大和其它几个国家和地区获批上市。
VHL是一种罕见遗传疾病,它可异常激活癌症患者体内的缺氧诱导因子(HIF-2α)。HIF-2α因子从而在患者体内蓄积并导致良性和恶性肿瘤的形成。HIF-2α通路相关研究曾在2019年荣获诺贝尔生理学或医学奖。
Belzutifan是一款选择性新型口服HIF-2α抑制剂。2021年8月,该药获得美国FDA批准上市,用于治疗VHL疾病相关癌症,如肾细胞癌、中枢神经系统CNS血管母细胞瘤或胰腺神经内分泌肿瘤,这些患者无需立即接受手术治疗。2023年12月,该药再次获得FDA批准,用于晚期肾细胞癌成人患者的治疗,这些患者接受PD-1/PD-L1抑制剂和血管内皮生长因子酪氨酸激酶抑制剂(VEGF-TKI)治疗后发生疾病进展。

根据belzutifan在美国获批治疗VHL疾病相关癌症时的2期临床试验数据,在VHL相关RCC患者中报告的客观缓解率(ORR)为49%。所有获得缓解的VHL-RCC患者均从治疗开始随访至少18个月。在其它VHL相关非RCC肿瘤患者中,24例可评估的CNS血管母细胞瘤患者的ORR为63%,12例可评估的pNET患者的ORR为83%,CNS血管母细胞瘤有73%的患者缓解持续时间≥12个月,pNET有50%的患者缓解持续时间≥12个月。
本次belzutifan在中国拟纳入优先审评意味着,该药也有望加速惠及中国的VHL病相关癌症患者。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网.RetrievedFeb21,2024,From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]FDAapprovesbelzutifanforcancersassociatedwithvonHippel-Lindaudisease.RetrievedAugust13,2021,fromhttps://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-belzutifan-cancers-associated-von-hippel-lindau-disease
