悬浮无血清生产工艺,助力慢病毒载体大规模生产!
转自:医药观澜
在细胞疗法中,目的基因的递送方式是成败的关键,理想的基因载体应该具有以下特点:可严格控制表达,具有持续可控的治疗性作用、低副作用和低免疫原性、靶细胞特异性和靶细胞高转导效率、较大的装载容量,可递送大片段的治疗基因、可实现大规模的生产等。慢病毒载体(LVV)包装容量大、细胞毒性和免疫原性低、感染谱广、可实现稳定表达等优势,因此常用作免疫细胞疗法中的目的基因递送载体等。就CAR-T来说,目前全球上市的9款CAR-T细胞治疗产品中,有6款均使用慢病毒载体完成CAR-T细胞的制造。
01
慢病毒载体大规模生产趋势
悬浮无血清工艺
目前行业普遍使用的是第三代慢病毒载体——四质粒瞬时转染系统,即由1个包含目的基因的表达质粒GOI、2个包装质粒Rev和GagPol、1个包膜蛋白质粒VSV-G等4个质粒共转染HEK293细胞,整个生产工艺分为上游工艺(upstreamprocessing,USP)和下游工艺(downstreamprocessing,DSP)。USP主要是细胞培养和病毒包装,具体包括细胞复苏和扩增、细胞培养、四质粒瞬时转染。DSP主要是去除病毒收获液的杂质,提高纯度和滴度,保证载体的安全性和效率,具体包括收获澄清、DNA去除、层析、TFF、除菌过滤和灌装等环节。
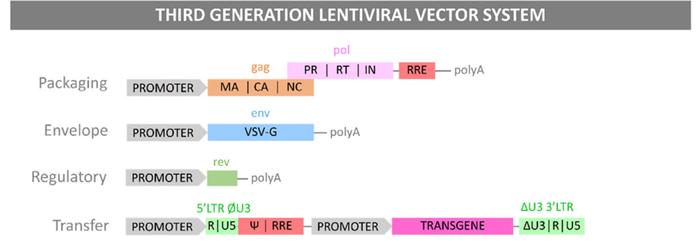
Fig1.第三代慢病毒载体原理。
From:Viruses2021,13(8),1528;https://doi.org/10.3390/v13081528
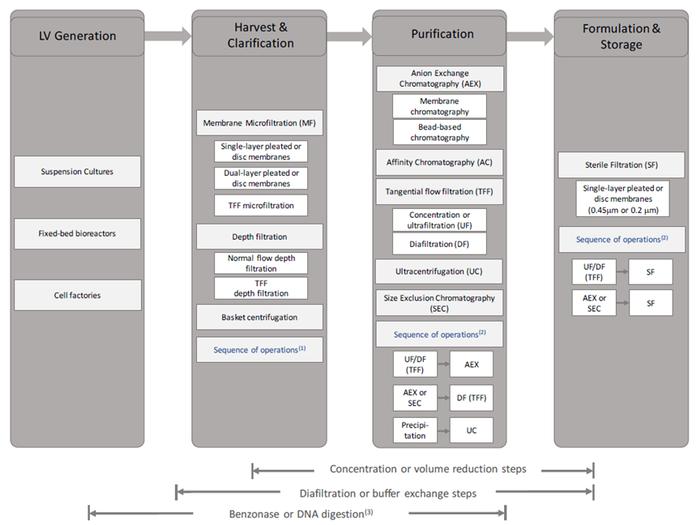
Fig2.慢病毒载体工艺概述
From:Viruses2021,13,268.https://doi.org/10.3390/v13020268
上游细胞培养多采用贴壁(如细胞工厂)或悬浮方式。贴壁工艺是成熟且广泛使用的慢病毒包装方法,操作简单,但在安全性和规模化生产上面临较大挑战,如放大困难,大规模生产时控制复杂,工艺不稳定,且贴壁工艺需要使用血清,成本高,成分不明确,生物安全风险高,且给下游纯化带来的挑战较大。与贴壁工艺相比,悬浮无血清工艺易放大,可实现全过程密闭操作,过程无菌控制简单,降低劳动力和生产空间,且使用无血清培养基,物料来源易于控制,但需建立稳定的悬浮细胞系,工艺开发和下游病毒澄清过滤挑战较大。
建议根据培养规模、所需剂量等具体项目要求选择最优的生产平台。就成本和可放大上考虑,基于悬浮培养的无血清工艺是慢病毒载体工艺开发的趋势。
02
悬浮无血清工艺开发中有哪些挑战
慢病毒载体悬浮无血清工艺开发过程中会遇到多项挑战,主要来源于载体本身特性、技术和上下游工艺开发等。
1.载体本身带来的挑战
慢病毒载体病毒颗粒较大且有包膜,因此对压力、剪切力、温度、盐浓度、pH等敏感,易失活,易聚集。
2.技术挑战:细胞株和包装系统
稳定高效的悬浮细胞系和包装质粒对慢病毒载体的产量和质量至关重要,传统哺乳动物细胞体外培养常依赖贴壁培养法,且需要添加血清,因此要将包装细胞从贴壁培养过渡到悬浮无血清培养,还要保证细胞状态,建立稳定高效的细胞系是技术上的一大挑战。
3.上游挑战
培养基,细胞密度和活率,转染方式、转染效率、质粒总量和配比、无动物源物料、放大复杂性、成本、工艺稳定性等。
4.下游挑战
慢病毒载体易失活和聚集、工艺稳定性、产品相关杂质如HCP,HCD等、剪切力,纯化填料和条件、除菌过滤损失、纯度和收率平衡等。慢病毒不稳定,颗粒大,易聚集,除菌过滤回收率低是行业目前的痛点。
03
应对挑战——工艺开发中需要关注
工艺开发的不同阶段中,需要关注的点也不尽相同。瞬时转染阶段,可重点关注的参数有转染时细胞密度、质粒DNA用量及比例、转染试剂、添加剂(例如添加剂类型、何时添加、添加浓度)等;生物反应器开发阶段,可重点关注补料、传质速率、混匀时间、搅拌速度及Powerperunitvolume(P/V);下游的工艺开发则可关注慢病毒载体稳定性、聚集度、杂质残留、纯度和收率的平衡等;放大阶段,关注保持相同的P/V值、线性放大通气策略、线性放大瞬时转染参数等。
以上条件均影响慢病毒载体的包装效率和质量,应基于QbD质量源于设计,以终为始的工艺开发策略,对工艺步骤、关键工艺参数和控制范围进行确认,并建立相应的过程控制检测标准。

Fig3.工艺开发策略-QbD框架
04
应对挑战——解决策略
1.科学的CMC(ChemicalManufacturingandControl,CMC)策略
CMC贯穿整个药物研发过程中,确保产品在每个阶段的安全性和有效性。在慢病毒载体方面,需要重点关注以下三个方面:确认物料符合要求、工艺及过程控制定义清晰、产品检测方法全面充分等。
2.先进的技术
高质量的生产细胞系对于慢病毒载体的产量和质量至关重要,药明生基使用自主开发且具有独立知识产权的高效稳定的HEK293慢病毒悬浮生产细胞株(无SV40LT,更安全)、OXGENE的包装质粒和自主开发的质粒包装系统,包装质粒骨架经优化后,降低了HIV/VSV的同源性,提高了安全性和包装能力。与其他普通包装质粒相比,OXGENE的包装系统可使慢病毒载体的滴度平均提高~10倍,经优化后的转染条件可使慢病毒载体的滴度提高4倍,显著提升慢病毒的包装滴度。此外,现货供应的质粒包装系统,可助力客户有效缩短研发周期,加快研发进程。
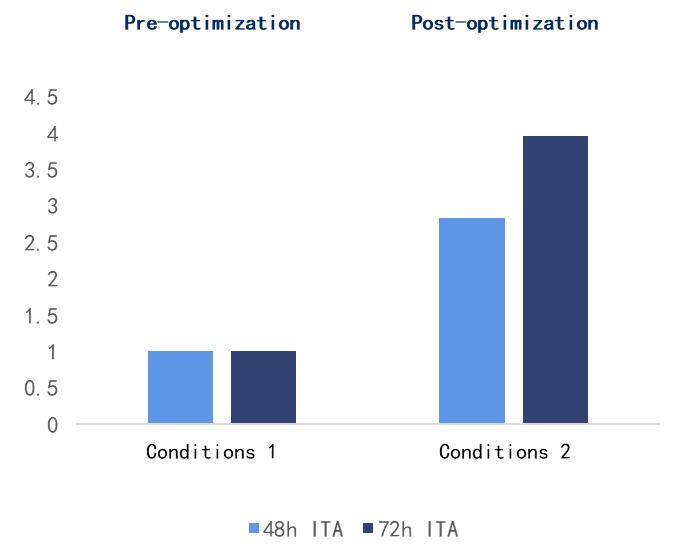
Fig4.经优化后的转染条件显著提升慢病毒载体滴度
工艺开发方面,由于慢病毒较大,除菌过滤回收率低,尤其对悬浮无血清工艺来说,工艺开发和下游病毒澄清过滤的挑战更大。药明生基遵循QbD原则,进行了上下游生产工艺参数优化,建立了工艺操作简单、易于放大、收率和产量稳定的悬浮慢病毒载体生产工艺。在实际案例中,流式检测上游产量可实现滴度> 5E+7TU/mL,下游整体回收率可达 40% 左右,详见以下图5和图6案例分享:
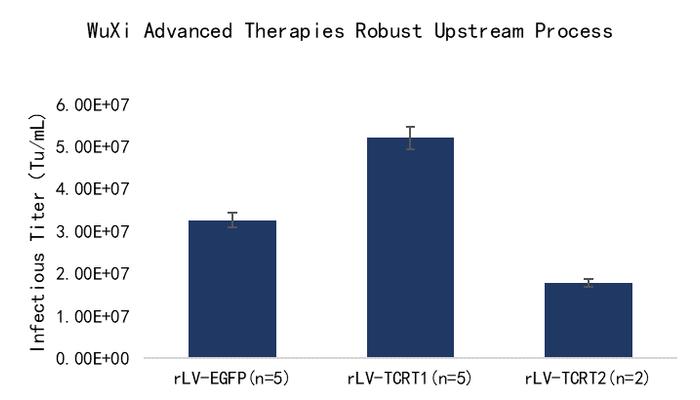
Fig5.悬浮无血清工艺上游慢病毒载体滴度(GOI=TCRT1,GOI=TCRT2)
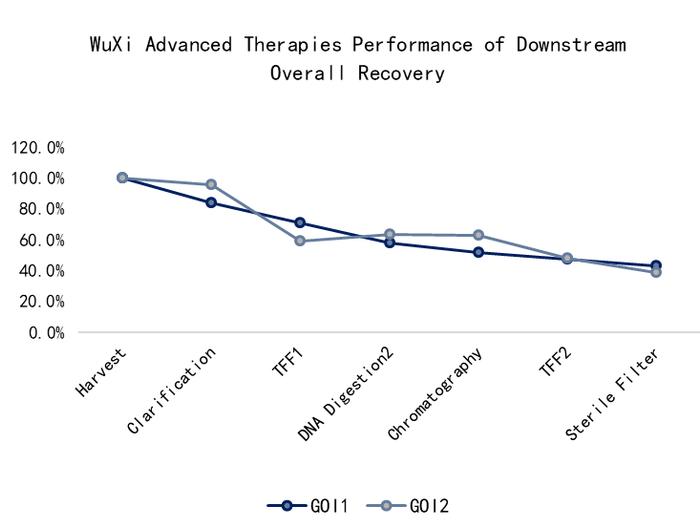
Fig6.悬浮无血清工艺下游慢病毒载体整体回收率
3.完善的平台能力
药明生基慢病毒载体CTDMO平台具有摇摆式生物反应器和搅拌式生物反应器,灵活性的生产规模可放大至500L以上。50~200L/批,从复苏到灌装周期仅20天;平台具有完善全面的分析方法开发及检测能力,为工艺开发控制策略及产品质量提供支持及保障;通过EP等多家权威机构认证的生产场地,设计符合美国、欧盟和中国法规要求;质量体系和流程满足全球GMP要求,支持多国申报。
Fig7.全面的慢病毒载体检测能力,覆盖从研发到上市整个药品生命周期
药明生基慢病毒载体CTDMO平台
药明生基慢病毒载体CTDMO平台涵盖四质粒瞬转贴壁、四质粒瞬转悬浮、LentiVV稳转细胞株平台等多种生产技术,灵活多样的工艺满足客户从临床前开发、临床到商业化不同阶段的生产需求。
1.药明生基具有成熟的悬浮工艺(无血清)和贴壁工艺生产技术,悬浮工艺实现可放大、自动化封闭式工艺,提高工艺控制能力,工艺稳健性。
2.药明生基LentiVV稳转细胞生产平台提供慢病毒载体颠覆性的生产解决方案,包括稳转悬浮细胞系LentiVVPackagingCellLine和LentiVVProducerCellLine。与传统的四质粒转染生产技术相比,LentiVVPackagingCellLine只需要一个质粒,显著降低了质粒生产成本和工艺开发复杂性。而基于PackagingCellLine开发的LentiVVProducerCellLine则提供了一种无需质粒的慢病毒载体生产方法,大大节约了质粒成本和转染试剂成本、降低了操作复杂性并显著提高了工艺稳健性。药明生基LentiVV稳转细胞生产平台可实现与四质粒转染方法相当甚至更高的慢病毒载体产量及产率,为大规模慢病毒载体生产提供了更加低成本、高效便捷的解决方案。
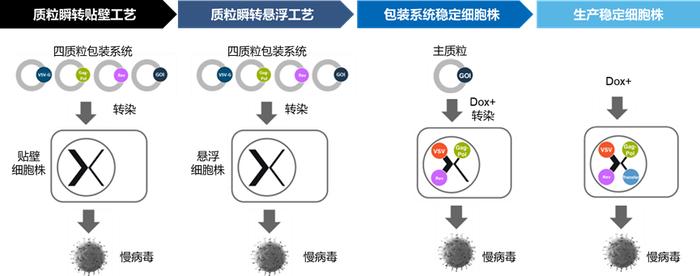
Fig8.药明生基慢病毒载体CTDMO服务平台
截至2023年第二季度,药明生基为总计 69 个项目提供工艺开发、检测与生产服务,包括7个临床III期项目(其中2个项目处于上市申请审核阶段,2个项目处于上市申请准备阶段),10个临床II期项目,以及 52 个临床前和临床I期项目。
2023年上半年,公司已助力客户完成一个将成为世界首个创新肿瘤淋巴细胞疗法(TIL)项目的FDA上市许可申请(BLA);以及助力客户完成一个CAR-T细胞治疗的慢病毒载体(LVV)项目的BLA,成为中国首家通过国家药品监督管理局食品药品审核查验中心(CFDI)LVV注册现场核查的CGTCDMO。
+86(021)37181888
info_ATU@wuxiapptec.com
我们将第一时间联系您!
或关注药明生基微信公众号,获取更多资讯!
1.LabbéRP,VessillierS,RafiqQA.LentiviralvectorsforTcellengineering:clinicalapplications,bioprocessingandfutureperspectives[J].Viruses,2021,13(8):1528.
2.PerryC,RayatACME.Lentiviralvectorbioprocessing[J].Viruses,2021,13(2):268.
3.MertenOW,HebbenM,BovolentaC.Productionoflentiviralvectors[J].MolecularTherapy-Methods&ClinicalDevelopment,2016,3.
4.McCarronA,DonnelleyM,McIntyreC,etal.Challengesofup-scalinglentivirusproductionandprocessing[J].Journalofbiotechnology,2016,240:23-30.
5.MacchiaruloE,BassettP,DudleyM.Challengesandprogressinlentiviralvectorbioprocessing[J].Cell&GeneTherapyInsights,2018,4(10):915-925.
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
