Nat Chem Biol | 陈鹏与合作者开发面向磷酸蛋白组的生物正交“脉冲追踪”技术
转自:生物谷
生命体与活细胞内的信息传递,依赖错综复杂的信号转导通路及相互作用网络。激酶信号通路与细胞增殖、疾病发展密切相关,具有重要的研究价值;然而,激酶又具有快速响应、级联激活的特点,给在活细胞内原位研究激酶生理功能带来了挑战。一方面,传统方式难以在活细胞内特异性地激活某一个目标激酶,精准追踪其下游信号通路,而避免对目标以外的干扰;另一方面,激酶激活后在数秒到数分钟内产生快速而广谱的下游信号转导,传统方式难以高时间分辨率且系统地发现并解析不同蛋白响应的时序信息。想象在雪山上发生雪崩时,整个过程顷刻而至,然而从微观层面上,首先有一处裂隙形成冰晶发生不起眼的位移,从源头引发邻近的积雪滑动,然后再扩散到更大范围,引起整体的雪层发生崩塌。为了看清这种扰动发生的时序和传递的路线,需要高速、高清的摄像机记录下全过程。同样在细胞信号转导通路中,开发一种高时间分辨的激酶激活与组学解析策略,能系统而有效地刻画这类复杂而动态的生命过程。
2024年1月2日,北京大学、北大-清华生命科学联合中心陈鹏课题组和南方科技大学田瑞军课题组合作在NatureChemicalbiology期刊上以长文形式报道了一种基于生物正交脱笼和蛋白质组学策略的活细胞激酶“脉冲追踪”技术(DecagingKinasecoupledproteomics,DeKinomics),实现了高时间分辨的激酶信号转导原位解析。值得一提的是,NatureChemicalbiology期刊同期还邀请合肥工业大学李宜明教授以新闻与观点(News&Views)的形式,对该工作进行了介绍。该文章以Lightingupkinase-contactsinsitu为题,评述了DeKinomics秒级分辨的技术特色以及泛素化相关的生物学发现。

陈鹏课题组长期致力于发展适用于活细胞的生物正交反应,并率先提出生物正交剪切反应的概念【1】,即通过对目标蛋白关键残基的保护-脱保护,实现对其活性的原位“关-开”调控(即笼蔽-脱笼,caging-decaging)。这种方法普适性广,对蛋白结构改动小,可以最大程度还原天然蛋白的活性。在前期的研究工作中,陈鹏课题组将生物正交剪切反应运用于多种氨基酸残基的脱笼,在活细胞中实现了不同种类酶活性的原位、瞬时激活【2-4】。
田瑞军课题组长期致力于开发高灵敏的功能蛋白质组学技术,用于在系统水平上揭示细胞信号转导相关蛋白修饰位点和互作的时-空调控变化。课题组开发了高通量的酪氨酸磷酸化富集技术【5】,发展了表征信号转导复合物的高选择性邻近标记蛋白质组学技术【6】和光交联化学蛋白质组学技术【7】。针对病理条件下信号转导通路,课题组通过磷酸化和复合物层面的功能蛋白组学研究,揭示了胰腺癌中的关键信号转导复合物【8】。
在最新的成果中,他们将激酶瞬时激活方法与定量磷酸化蛋白质组学技术相结合,开发了激酶“脉冲追踪”技术DeKinomics,实现了活细胞中特定激酶的高时间分辨组学研究,解析了其直接内源底物及下游级联信号通路。在Dekinomics技术中,通过“遗传密码子扩展+生物正交剪切反应”的化学生物学策略,在目标激酶的活性赖氨酸位点定点插入ONP保护的赖氨酸衍生物ONPK,笼蔽激酶活性;随后利用高时间分辨的紫外光照脱除ONP保护基团,释放赖氨酸的侧链氨基,实现激酶的特异性激活;在目标激酶激活后数秒至数分钟内,固定和捕捉细胞磷酸化图景,开展磷酸化蛋白质组学分析,精准揭示激酶下游信号通路响应的时间信息。
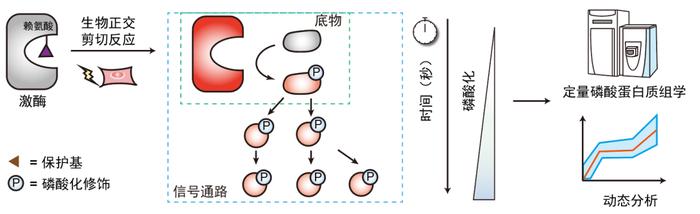
通过对激酶信号通路的定量磷酸化蛋白质组学分析,该工作获得了以下结论:1)DeKinomics实现了秒级分辨率的活细胞内激酶激活;目标激酶激活数秒内即引起特异的下游磷酸化信号级联,这种响应能被磷酸化蛋白质组学精准定量。2)从DeKinomics高时间分辨的磷酸化蛋白质组学数据中,寻找响应速度最快的磷酸化位点,是鉴定目标激酶细胞内源直接底物的有效策略。3)DeKinomics适用于多种类型激酶的功能研究,包括丝氨酸/苏氨酸激酶、非受体酪氨酸激酶、受体酪氨酸激酶及癌症中出现的融合激酶。这些都证明了DeKinomics策略是一项普适性、精准性的激酶生物学研究技术。
从DeKinomics磷酸化蛋白质组学的大数据中,挖掘激酶的内源直接底物,进行分子机制的精细探索,能揭示未知的细胞调控机制。本文中,结合近年来新发展的酪氨酸超亲体(superbinder)富集技术,研究人员在SRC激酶激活后的6000余个酪氨酸磷酸化位点中,确定了269个SRC的潜在底物,其中泛素E1连接酶UBA1的Y55位磷酸化引起了他们的关注。细胞中的泛素化修饰超过99%都是通过UBA1活化,经由泛素E2-E3连接酶最终修饰到蛋白上【9】。UBA1相当于细胞内泛素化的“总闸门”。尽管UBA1的Y55位磷酸化是目前在组学上被鉴定到最多的翻译后修饰(PhosphoPlus数据库),但该位点的磷酸化功能尚未被发掘。研究人员通过对UBA1的结构分析,Y55位点磷酸化很可能会影响UBA1结合ATP。因此,研究人员预测Y55位点磷酸化会对UBA1的催化活性造成影响,并利用实验证明了UBA1-Y55位点的磷酸化可以抑制UBA1形成E1~Ub硫酯中间体,阻碍下游E2~Ub生成。实验结果不仅揭示了UBA1活性调控的新机制,而且提示了酪氨酸磷酸化和泛素化在修饰酶层面串扰(crosstalk)的新机制:泛素化介导的激酶降解是一种激酶活性的负反馈调节机制【10】,这一机制所依赖的泛素化能够被SRC介导的UBA1酪氨酸磷酸化所抑制。除SRC外,研究人员还绘制了受体酪氨酸激酶TYRO3特异的磷酸化介导信号转导图谱,发现了TYRO3-PRKCD信号转导通路,提示了癌症靶向协同治疗的新思路。
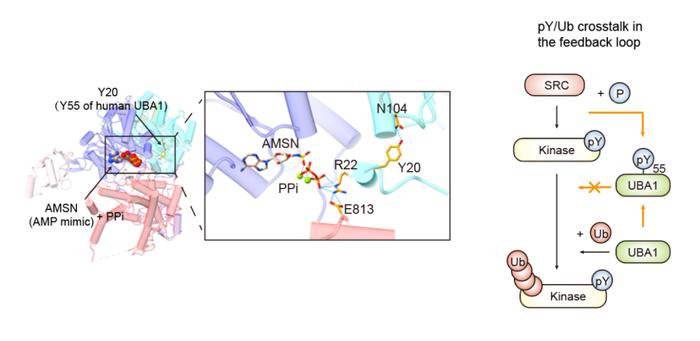
图:SRC磷酸化UBA1的Y55位点,通过影响ATP结合口袋构象来抑制UBA1的泛素连接酶活性,进而干扰泛素介导的激酶降解这一负反馈调节过程。
综上,这项工作为活细胞中的激酶功能研究提供了普适性、精准性的“脉冲追踪”技术,以秒级的超高时间分辨率对特定激酶的底物和下游信号通路进行了系统解析。
北大-清华生命科学联合中心陈鹏教授和田瑞军教授为本文的共同通讯作者,北京大学前沿交叉学科研究院博士生/南方科技大学博士后翁亦澄(现为上海交通大学生物医学工程学院助理研究员),南方科技大学博士后陈文东、孔倩为共同第一作者。
原文链接:https://www.nature.com/articles/s41589-023-01497-x
