2980元一盒!新冠口服药,网售又见“秒下架”!国家药监局:此类行为,查处!
12月13日傍晚,辉瑞口服抗新冠病毒药物Paxlovid(奈玛特韦/利托那韦片)一度悄然登陆1药网。
据媒体报道,针对1药网APP是否在预售新冠口服抗病毒药物Paxlovid(奈玛特韦/利托那韦片)一事,1药网方面表示:“1药网并非网售辉瑞的Paxlovid药品,而是按照国务院防控机制办公室2022年12月12日发布的《关于做好新冠肺互联网医疗服务的通知》,通过互联网医院为符合条件的患者提供诊疗和用药服务。”
记者在1药网网页上搜索Paxlovid,果然看到相关产品。
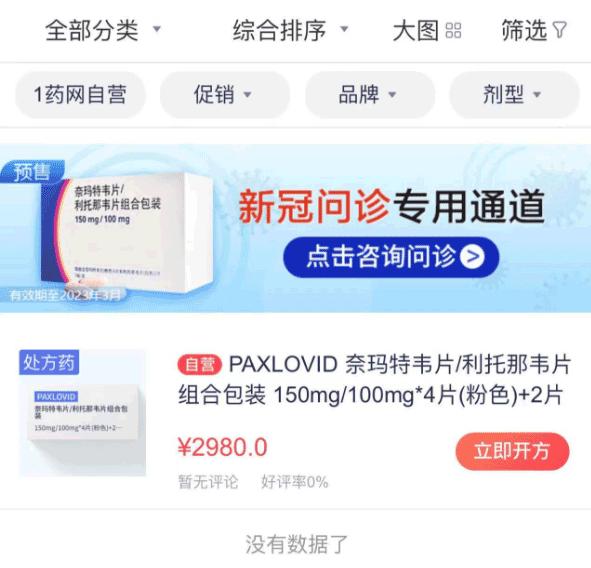
但按步骤下载客户端后再搜索该药品,Paxlovid药品链接已不再显示。
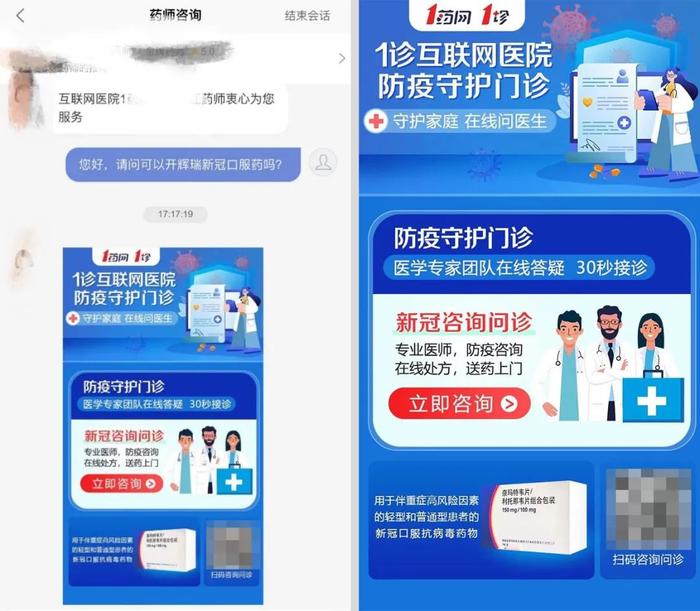
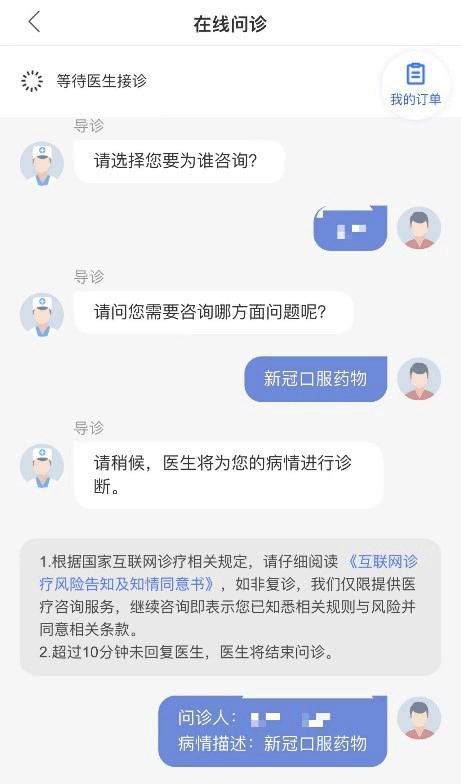
根据此前报道,1药网App显示,其旗下互联网医院可以预售辉瑞Paxlovid,定价为2980元/盒。北京地区显示18时前下单,预计当天出库。用户在咨询问诊后,由医生确认是否已确诊新冠,购买者需上传核酸或抗原阳性照片,获得Paxlovid处方。
目前,线上购药尚未接入医保,每盒2980元的定价高于医疗机构对Paxlovid的医保采购价2300元。
报道称,医生强调该药不能用于预防,仅用于确诊患者的治疗,需要用户上传核酸或抗原阳性证明后开具处方。上传抗原阳性照片后,被诊断为新冠病毒感染,即顺利开出Paxlovid处方,每次口服3片,每天两次,线上付款后可以快递配药到家。
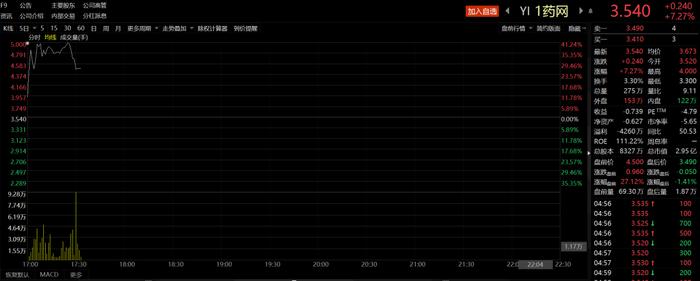
二级市场上,短时间内1药美股网盘前涨超40%。
政策已“开闸”
截至目前,国内共批准两款新冠口服药上市,除Paxlovid外,另一款是真实生物生产的阿兹夫定,两种药品同属于处方药。
11月19日,国产新冠口服药阿兹夫定片线上销售引发关注。当日,真实生物研发的阿兹夫定片被传正式在线上开售,医保挂网价每瓶270元的阿兹夫定片,在线上药店的价格为350-490元/瓶不等。但不久后,该药品即被多家线上药店下架。随后真实生物发布声明,互联网线上售卖的阿兹夫定片实为抗HIV-1适应症药品。
相较此前,现在的政策已经打开。
12月12日,国务院联防联控机制发布《关于做好新冠肺炎互联网医疗服务的通知》,明确医疗机构(包括互联网医院、开展互联网诊疗服务的医疗机构)可在线开具治疗新冠肺炎相关症状的处方,鼓励委托符合条件的第三方将药品配送到患者家中。
国产新冠口服药或将问世
此前,Paxlovid及其印度仿制药Primovir和Paxista的海外代购生意火爆。曾有媒体报道称,部分代购从今年4月起开始为中国顾客代购,11月防疫措施优化后订单激增,不到一月卖出超过5万盒,约占总销量的三分之一。其印度仿制药每盒售价在900-2000元不等。
11月24日,石药集团发布公告,称其开发的“SYHX1901片”已获药监局批准,用于治疗重症新冠肺炎成人患者的临床试验。
公开资料显示,石药集团在今年9月份已针对辉瑞Paxlovid的两种主要组成部分奈玛特韦(nirmatrelvir)和利托那韦(ritonavir),注册了自研产品的生物等效性(BE)试验。
国家药监局召开加强
新冠病毒抗原检测试剂
质量安全监管视频调度会
12月13日,国家药监局召开加强新冠病毒抗原检测试剂质量安全监管视频调度会,深入贯彻落实国务院联防联控机制近期关于疫情防控有关要求,强化注册人主体责任落实和属地监管责任落实,全力保障新冠病毒抗原检测试剂质量安全。国家药监局党组成员、副局长徐景和出席会议并讲话。
复星诊断科技(上海)有限公司、南京诺唯赞医疗科技有限公司、浙江东方基因生物制品股份有限公司、深圳市亚辉龙生物科技股份有限公司、重庆中元汇吉生物技术股份有限公司的主要负责人,汇报了企业落实主体责任、加强生产质量管理工作等有关情况。江苏省、福建省、重庆市药监局的负责同志汇报了加强新冠病毒抗原检测试剂生产经营环节质量安全监管工作情况。
会议指出,近期,疫情防控新十条优化措施、新冠病毒抗原检测应用方案相继出台,对新冠病毒抗原检测试剂质量安全提出新的要求,各新冠病毒抗原检测试剂注册人和监管部门要进一步提高政治站位,深刻认识加强抗原检测试剂质量监管的特殊重要性,以更加担当的精神和更加扎实的工作,确保抗原检测试剂的质量安全。
会议要求,各新冠病毒抗原检测试剂注册人、生产经营企业要全面落实《医疗器械监督管理条例》及其配套规章制度要求,坚持问题导向,强化底线思维,聚焦质量安全风险隐患,对标质量管理体系要求,全面开展排查治理。注册人作为产品质量安全的第一责任人,要严格执行生产质量管理规范要求,不得脱离质量管理体系进行生产,不得擅自变更或者增加生产地址,不得放行不合格产品出厂和上市,不得随意修改产品标签和说明书。经营企业要严格执行经营质量管理规范要求,不得脱离经营质量管理体系进行经营,不得无证或者无资质从事经营活动,不得经营或者进口不符合法定要求的产品,不得从非法渠道购进产品,不得擅自变更经营场所和库房地址,不得违规运输或者贮存产品,不得违法违规开展网络销售活动;网络交易服务第三方平台不得违法违规提供网络交易平台服务。各新冠病毒抗原检测试剂注册人、受托生产企业、经营企业、网络交易服务第三方平台,要认真排查是否全面履行各项主体责任,确保责任落实到位,体系运行到位,风险防控到位,质量管理到位。
会议强调,各级药品监管部门要认真贯彻落实党中央、国务院决策部署,始终牢记人民健康是“国之大者”,坚持人民至上、生命至上,慎终如始、再接再厉,全力保障抗原试剂质量安全。要强化质量管理体系检查,组织专业力量对本辖区新冠病毒抗原检测试剂注册人及其受托生产企业、网络交易服务第三方平台开展监督检查。发现存在违规行为,不能保证产品安全有效的,要责令企业立即暂停生产、召回问题产品并进行有效处置;违规情节严重的,要依法吊销医疗器械生产许可证,并对相关责任人依法进行处罚。要继续加强新冠病毒抗原检测试剂的质量监督抽检,对辖区内注册人、受托生产企业生产的新冠病毒检测试剂开展全覆盖抽检。对于监督抽检不合格产品,要立即采取处置措施,责令企业暂停生产、分析查找原因并开展整改,未经省级药品监管部门复查复检合格,不得恢复生产。对监督检查、监督抽检、投诉举报、网络监测、风险会商等工作中发现的问题和线索,要深挖细查,一查到底。对各类违法违规行为,要依法从严从重从快查处。涉嫌犯罪的,要及时移送公安机关。监管人员和其他公职人员涉嫌失职渎职的,要及时移送纪检监察机关。
各省、自治区、直辖市和新疆生产建设兵团药监局分管局领导及相关处室负责同志、各新冠病毒抗原检测试剂生产企业主要负责人在各自分会场参加会议。国家药监局有关司局和直属单位的有关负责同志参加会议。
(来源:综合本报、国家药品监督管理局网站)
责编:郭晨希 校对:冯雯君
