治疗脱发的RNAi疗法、有望功能性治愈糖尿病的细胞疗法步入临床... | 一周盘点
转自:药明康德
本期看点
1.肿瘤免疫治疗新药Galinpepimut-S联用纳武利尤单抗用于治疗WT1+复发性卵巢癌患者的早期临床数据亮眼,超过90%的患者可产生明确的特异性T细胞反应,患者的一年无进展生存率(PFS)达70%。
2.靶向BCMA的自体CAR-T细胞疗法NXC-201用于治疗多发性骨髓瘤和AL淀粉样变性,总缓解率高达90%和100%。
3.用于治疗雄激素性脱发的RNAi疗法OLX104C进入临床,有望克服全身暴露带来的性功能下降、抑郁等副作用,以及女性患者难以使用的局限性。
4.一款干细胞分化产生的胰岛细胞疗法VX-264进入临床,该疗法具有在不需要使用免疫抑制剂的情况下,功能性治愈1型糖尿病的潜力。
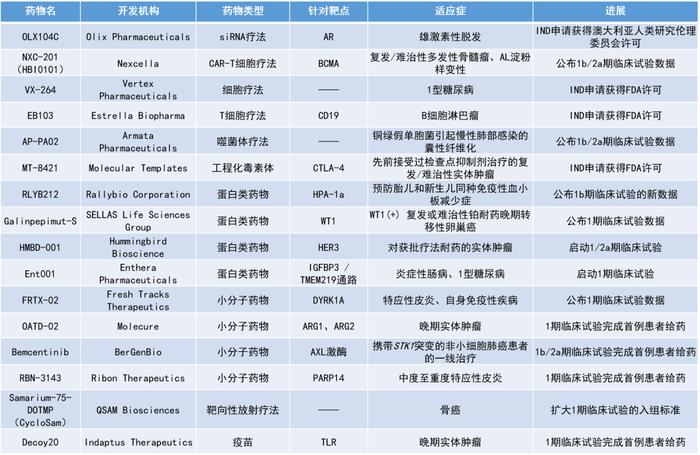
Galinpepimut-S:公布1/2期临床试验数据

SELLASLifeSciencesGroup公司公布了其靶向WT1蛋白的潜在“first-in-class”肿瘤免疫治疗新药Galinpepimut-S(GPS)联用PD-1抑制剂纳武利尤单抗用于治疗WT1+复发性卵巢癌患者的1期临床数据。该药由4条多肽链构成,抗原表位多达25个,适用于全球范围内绝大多数人类白细胞组织相容性抗原(HLA)类型,能够激发自身免疫系统对WT1抗原强烈的免疫反应。
研究结果显示,GPS产生的免疫反应比预期得更广,91%的患者在治疗后产生了明确的WT1特异性T细胞反应。在挽救性化疗后接受两次或两次以上GPS联用纳武利尤单抗治疗作为维持免疫治疗的患者中,接受治疗一年时的PFS为70%。而在没有任何维持治疗的情况下,患者群体的历史一年PFS为55%。此外,数据表明,表达WT1的卵巢癌患者可以获得对GPS免疫治疗的持久反应,从而延缓可测量的疾病复发。这与单独的挽救性化疗形成鲜明对比,后者通常会产生短暂的反应然后迅速复发,并需要接受后续治疗,这意味着患者的结局更差、累积毒性的负担增加。
NXC-201:公布1b/2a期临床试验的新数据

Nexcella公司公布了其靶向BCMA的自体CAR-T细胞疗法NXC-201的1b/2a期临床试验的新数据。该研究旨在评估NXC-201用于治疗复发/难治性多发性骨髓瘤和AL淀粉样变性的安全性和有效性。
截至2022年10月23日的数据,NXC-201在复发/难治性多发性骨髓瘤患者中表现出潜在有意义的疗效和持久的反应。在42例接受2期临床推荐剂量(RP2D)NXC-201的多发性骨髓瘤患者中,观察到的总缓解率(ORR)为90%,完全缓解(CR)率为59%。在5例接受NXC-201治疗的复发/难治性AL淀粉样变性患者中,产生了100%的ORR和100%的器官缓解率。此外,NXC-201的耐受性良好,42例可评估的患者中未观察到免疫效应细胞相关神经毒性综合征(ICANS),观察到的细胞因子释放综合征(CRS)均可控。
OLX104C:IND申请获得澳大利亚人类研究伦理委员会许可

OLX104C是Olixpharmaceuticals公司基于其不对称siRNA(cp-asiRNA)平台开发的以雄激素受体(AR)为靶点的RNAi疗法,用于治疗雄激素性脱发。雄激素性脱发是男性荷尔蒙睾酮被5α-还原酶(5-alphareductase)转化为二氢睾酮(DHT)后,DHT与AR的结合引起的,这会影响毛囊,导致头皮前部和头顶部位的毛发逐渐变短变细,最终引起脱发。该疗法通过局部注射到头皮,只会在脱发部位维持高浓度,进入血液后会迅速分解,因此有望克服全身暴露带来的性功能下降、抑郁等副作用,以及女性患者难以使用的局限性。
VX-264:IND申请获得FDA许可

VX-264是VertexPharmaceuticals公司开发的一款干细胞分化产生的胰岛细胞疗法,旨在治疗1型糖尿病。1型糖尿病患者由于免疫系统破坏了胰腺中产生胰岛素的胰岛细胞,从而导致胰岛素产生减少和高血糖。VX-264是一种细胞疗法和医疗器械的组合,将VX-880封装在Vertex开发的医疗器械中。这一装置可以通过手术植入到患者体内,在保护细胞不受免疫排斥的同时,释放细胞生成的胰岛素。2021年,Vertex公司曾公布过其基于干细胞分化的同种异体胰岛细胞疗法VX-880在首位接受治疗的患者中的疗效。在接受单剂VX-880治疗后第90天时,患者恢复胰岛素生产,并且将每天的胰岛素使用量减少了91%。Vertex计划在未来几个月里在1型糖尿病患者中启动1/2期临床试验。
EB103:IND申请获得FDA许可
EB103是EstrellaBiopharma公司利用ARTEMIS技术开发的靶向CD19的T细胞疗法。与传统的CAR-T细胞不同,利用ARTEMIS技术设计的T细胞疗法具有类似TCR-T细胞疗法的天然细胞内调控机制和CAR-T细胞疗法的精准性,有望大幅降低甚至消除与T细胞过度激活相关的CRS及其它与细胞因子相关的副作用。同时通过T细胞表面的共刺激分子协助,可产生足够的T细胞激活信号,促进T细胞活化,强化抗肿瘤效果。由于CD19是一种在几乎所有B细胞白血病和淋巴瘤表面表达的蛋白质,这为Estrella公司启动EB103的1/2期临床试验铺平了道路,有望用于治疗复发或难治性B细胞非霍奇金淋巴瘤(NHL)患者、人类免疫缺陷病毒(HIV)相关淋巴瘤以及原发性和继发性中枢神经系统(CNS)淋巴瘤。
AP-PA02:公布1b/2a期临床试验数据
ArmataPharmaceuticals公司公布了其新型吸入性多噬菌体疗法AP-PA02的积极早期临床结果。该疗法可以通过雾化有效地输送到肺部,用于治疗囊性纤维化患者的慢性肺铜绿假单胞菌感染。此次公布的数据显示,AP-PA02的耐受性良好,治疗伴发不良反应(TEAE)的特征与安慰剂相似。该候选疗法的全身暴露量小,单次剂量递增与多次剂量递增研究中对诱导痰液进行了检测,发现其暴露量成比例增加,表明其药代动力学是可预测的。研究人员在几个时间点测量了受试者痰液中铜绿假单胞菌的细菌水平,并与给药前的基线水平进行了比较。结果表明,给药10天后,接受AP-PA02治疗的受试者与安慰剂组患者相比,在治疗结束时细菌载量的减少有所改善。
MT-8421:IND申请获得FDA许可
MT-8421是MolecularTemplates公司利用其专有的药物平台开发的靶向CTLA-4的工程化毒素体(EngineeredToxinBodies,ETBs),用于治疗先前接受过检查点抑制剂的复发/难治性实体肿瘤患者。MT-8421以一种与当前的单克隆抗体完全不同的方式靶向CTLA-4,旨在通过直接的细胞杀伤机制消除肿瘤微环境(TME)中表达CTLA-4的调节性T细胞(免疫抑制性调节性T细胞),该机制独立于抗体所依赖的效应细胞的存在,同时不影响外围的调节性T细胞。临床前数据显示,在表达人CTLA-4并携带同系皮下肿瘤的转基因小鼠模型中,MT-8421治疗消耗了TME中的免疫抑制性调节性T细胞,同时不影响外围的调节性T细胞。该公司预计将在2023年年中启动MT-8421的首次人体1期研究。
RLYB212:公布1b期临床试验的新数据
RallybioCorporation公司公布了RLYB212的1b期临床试验的新结果。RLYB212是一种用于预防胎儿和新生儿同种免疫性血小板减少症(FNAIT)的抗人类血小板抗原1a(HPA-1a)单克隆抗体。FNAIT是一种由于准妈妈和她的胎儿的HPA-1特定血小板抗原免疫不相容导致的罕见疾病,母亲体内产生的抗HPA-1a抗体可以穿过胎盘并破坏胎儿的血小板,可能导致包括流产、死产、新生儿死亡或存活婴儿的严重终生神经功能障碍在内的多种严重后果。目前尚无批准用于预防或治疗FNAIT的疗法。
此次公布的新数据表明,在严重胎儿母体出血的模型中,单次皮下给药一周后,两种剂量的RLYB212相比于安慰剂都能够更迅速地消除输注的HPA-1a阳性血小板,平均血小板消除半衰期减少了90%以上,且呈剂量相关性。此外,RLYB212的耐受性良好,无严重不良事件(SAE)。
HMBD-001:启动1/2a期临床试验
HMBD-001是HummingbirdBioscience公司开发的靶向HER3的IgG1抗体,用于治疗对获批疗法耐药的实体肿瘤患者。该候选疗法有可能通过靶向位于HER3与HER2或EGFR形成异二聚体的连接处的关键表位,完全阻断配体依赖性和非依赖性HER3激活和致癌信号。在临床前模型中,该公司观察到HMBD-001与现有的HER3抗体相比具有更好的亲和力和更有效的肿瘤生长抑制作用。
Ent001:启动1期临床试验
Ent001是EntheraPharmaceuticals公司开发的一种靶向IGFBP3/TMEM219通路的单克隆抗体,该通路在炎症性肠病和1型糖尿病中起关键作用。高水平的IGFBP3与TMEM219受体结合,将导致结肠干细胞和胰腺中产生胰岛素的β细胞凋亡。Ent001旨在与TMEM219结合以阻止细胞死亡和这些疾病状态背后的炎症的发生。该候选疗法的随机、双盲、安慰剂对照的单次递增剂量1期试验将在荷兰开展,以评估Ent001在30名健康成年受试者中的安全性、药代动力学(PK)、药效学(PD)以及免疫原性。
FRTX-02:公布1期临床试验数据
FreshTracksTherapeutics公布了其强效、高选择性、潜在“first-in-class”的口服DYRK1A抑制剂FRTX-02的1期临床试验数据。该试验旨在评估FRTX-02在健康受试者和特应性皮炎患者中的安全性、耐受性、药代动力学和药效学。研究结果显示,FRTX-02在潜在治疗剂量范围内通常是安全的,且耐受性良好,符合研究的主要目标;潜在治疗剂量范围内的血浆浓度与非临床疾病模型中建立的有效暴露水平一致,支持每日一次口服给药;在探索性离体LPS刺激的全血药效学测定中观察到疾病相关细胞因子的减少。该结果支持FRTX-02作为特应性皮炎和/或其他自身免疫性疾病的潜在“first-in-class“治疗。
