《药品年度报告管理规定》及《药品年度报告模板(2022年版)》发布【三分钟速览一周医药看点】
4月6日—4月12日
医药行业的这些动态值得关注
封面新闻
《药品年度报告管理规定》及《药品年度报告模板(2022年版)》发布 国家药监局发布《药品年度报告管理规定》及《药品年度报告模板(2022年版)》,规范药品上市许可持有人年度报告管理。《规定》自发布之日起施行,药品年度报告采集模块同时启用。该模块直接对接药品监管数据共享平台、实现了关键基础信息自动带出,便于持有人填报,2021年度报告信息填报时间截止到2022年8月31日。
行业·政策动态
1.《国务院关于修改和废止部分行政法规的决定》公布,自2022年5月1日起施行。此次修改和废止的行政法规共20部,其中对《放射性药品管理办法》等14部行政法规的部分条款予以修改,对工业产品质量责任条例(1986年4月5日国务院发布)等6部行政法规予以废止。此次将《放射性药品管理办法》第十条修改为“开办放射性药品生产、经营企业,必须具备《药品管理法》规定的条件,符合国家有关放射性同位素安全和防护的规定与标准,并履行环境影响评价文件的审批手续;开办放射性药品生产企业,经所在省、自治区、直辖市国防科技工业主管部门审查同意,所在省、自治区、直辖市药品监督管理部门审核批准后,由所在省、自治区、直辖市药品监督管理部门发给《放射性药品生产企业许可证》;开办放射性药品经营企业,经所在省、自治区、直辖市药品监督管理部门审核并征求所在省、自治区、直辖市国防科技工业主管部门意见后批准的,由所在省、自治区、直辖市药品监督管理部门发给《放射性药品经营企业许可证》。无许可证的生产、经营企业,一律不准生产、销售放射性药品。”此外,对相关行政法规中的条文序号作相应调整。
2.国家药监局药审中心(CDE)就《〈已上市化学药品药学变更研究技术指导原则(试行)〉中溶出曲线研究条件的问答(征求意见稿)》公开征求意见。征求意见稿对普通口服固体制剂、缓控释制剂及肠溶制剂的溶出曲线研究条件进行解读,内容包括溶出介质选择、装置及转速选择、溶出曲线取样点的选择以及相似性评价等。征求意见截止日期为2022年5月6日。
3.CDE就《双特异性抗体类抗肿瘤药物临床研发技术指导原则(征求意见稿)》公开征求意见,以对BsAb类抗肿瘤药物的临床研发中,需要特殊关注的问题提出建议,并指导企业更为科学地进行双特异性抗体的临床研发。征求意见截止日期为2022年5月10日。
产品研发·上市信息
1.国家药监局通过优先审评审批程序批准辉瑞公司申报的1类创新药阿布昔替尼片(商品名:希必可/CIBINQO)上市。该药适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人患者。
2.国家药监局发布2期药品批准证明文件待领信息,共包括199个受理号,涉及华兰生物工程重庆有限公司等企业(截至4月12日)。
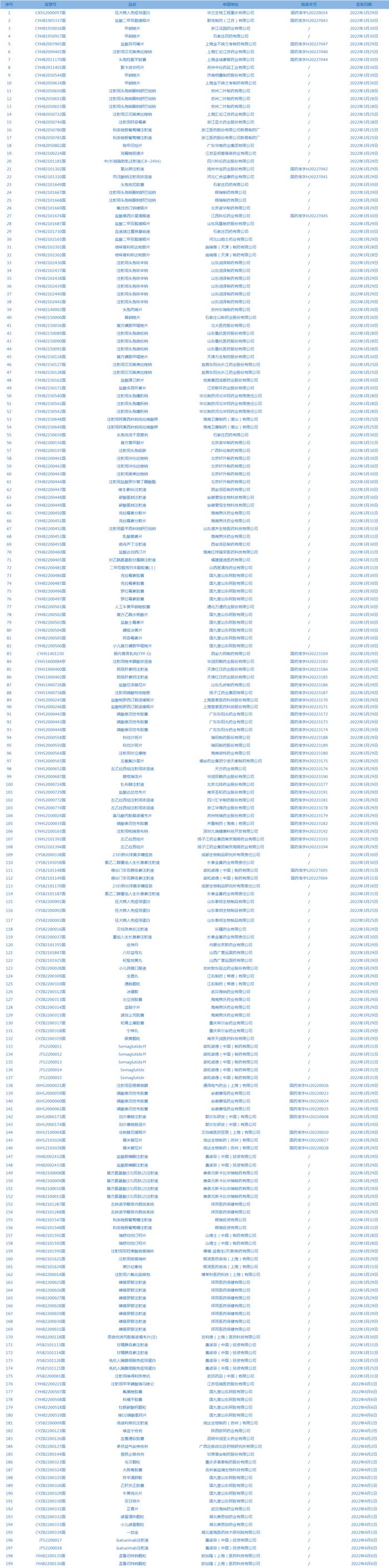
3.CDE网站公示11个仿制药一致性评价任务,涉及头孢拉定胶囊等药品(截至4月12日)。
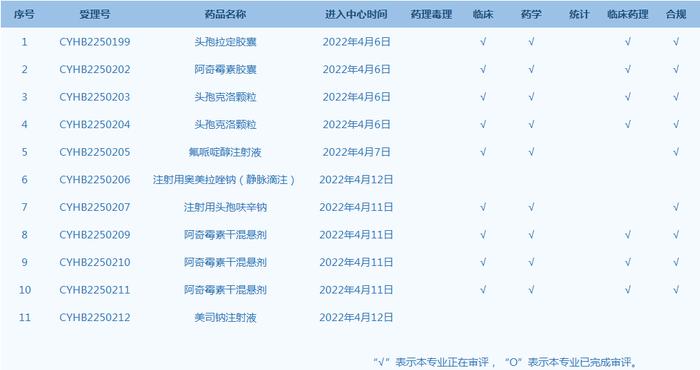
4.CDE承办受理26个新药上市申请,包括注射用DNV3等药品(截至4月12日)。
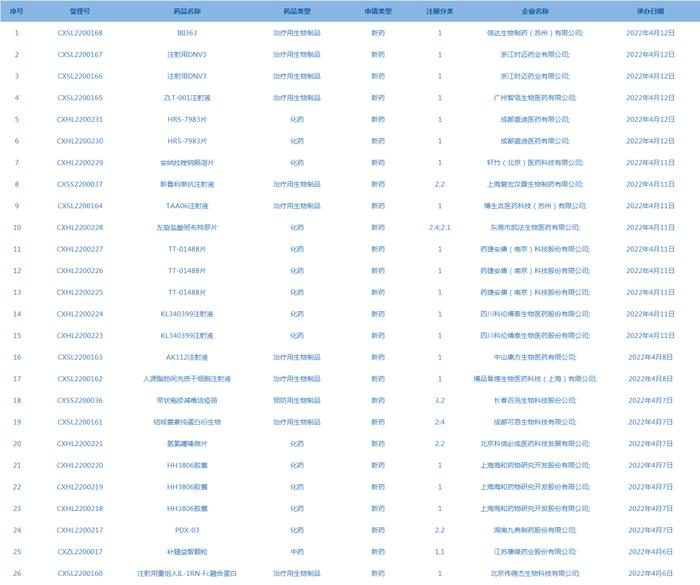
5.CDE网站信息显示,IN10018片、IBI310、信迪利单抗注射液、TQB2450注射液被列入拟突破性治疗品种(截至4月12日)。

医药企业观察
1.君实生物发布公告称,其全资子公司TopAllianceBiosciences,Inc.抗CD112R单克隆抗体注射液(项目代号“TAB009/JS009”)用于治疗晚期实体瘤的临床试验申请获得美国FDA批准。
2.百济神州发布公告称,公司产品替雷利珠单抗注射液用于治疗既往接受过全身化疗的晚期或转移性食管鳞状细胞癌患者,以及非小细胞肺癌患者的新适应症上市许可申请获得欧洲药品管理局(EMA)受理。
3.华东医药发布公告,其控股子公司道尔生物获得新西兰药品和医疗器械安全管理局(Medsafe)、健康及残疾伦理委员会(HDEC)的最终批准,获准在当地开展注射用DR10624的I期临床试验。
4.复星医药发布公告称,控股子公司HengenixBiotech,Inc.收到美国FDA关于斯鲁利单抗注射液用于小细胞肺癌(SCLC)治疗获得孤儿药资格认定的函。
5.康诺亚生物发布新闻稿称,其核心产品靶向Claudin18.2的抗体偶联药物CMG901获得美国FDA授予用于治疗晚期胃癌及胃食管结合部腺癌的孤儿药资格。
6.华海药业发布公告称,其向美国FDA申报的利格列汀二甲双胍片和奈必洛尔片的新药简略申请(ANDA)已获得暂时批准。
7.普洛药业发布公告称,控股子公司普洛康裕制药产品左氧氟沙星片通过了WHO的预认证(PQ)审核,并已在WHO网站公示。
8.和铂医药宣布与阿斯利康就CLDN18.2xCD3双特异性抗体HBM7022的开发与商业化达成全球对外授权协议。
9.锐明新药宣布完成新一轮亿元级融资。本轮融资由华润正大生命科学基金领投,金鼎资本跟投,募集资金将主要用于其多款产品的临床试验申报、临床探索和新项目的引进。
药械集中采购
1.北京市委市政府印发《关于深化医疗保障制度改革的若干措施》,明确要求深化药品、医用耗材集中带量采购制度改革。平稳实施药品、医用耗材集中带量采购。推进京津冀区域联盟药品、医用耗材带量采购,逐步形成跨省区域采购联盟,探索形成“国家—区域联盟—省(市)”三级采购体系。
2.广东省药品交易中心发布《关于公示广东联盟清开灵等中成药集中带量采购拟中选/备选结果的通知》。此次广东中成药集采联盟275家企业中,174家企业361个品种拟中选/备选,其中124家企业249个品种拟中选,56家企业112个品种拟备选。
3.山西省药械集中招标采购中心发布《关于开展中成药联盟集中带量采购约定采购量分配工作的通知》,就湖北牵头19省份(兵团)中成药联盟集采明确的17个产品组,开展山西省医疗机构约定采购量分配。通知明确医疗机构填报采购需求的产品若在中选范围,同竞争单元内降幅最高的中选产品按约定采购量分配给对应的医疗机构;其他中选产品按90%的约定采购量分配给对应的医疗机构。
4.陕西省医保局发布《关于开展医保药品支付标准试点工作的通知》,明确将汉防己甲素等29种药品纳入医保药品支付标准试点范围。全省定点医疗机构和定点零售药店,由医保统筹基金支付试点药品费用时,均按照确定的支付标准支付。
来源/中国食品药品网
文/刘思慧整理
