复星医药将全资收购复星凯特
复星凯特的CAR-T产品在中国市场策略将更加灵活。
中国细胞治疗领域迎来重大变化。
复星医药(股票代码:600196.SH;02196.HK)今日宣布,将全面收购其与KitePharma的合资企业复星凯特,并在完成收购后进行增资。复星凯特拥有中国首个获批的CAR-T产品。

复星医药全资收购复星凯特并增资
复星凯特是2017年复星医药与KitePharma共同出资设立,主要从事肿瘤免疫细胞治疗产品的研发、生产和商业化。
根据9月13日发布的公告,复星医药将以2700万美元收购KitePharma持有的复星凯特50%股权,使其成为全资子公司。
此次交易完成后,复星医药计划再投入1000万美元或等值人民币对复星凯特进行增资,进一步加码其细胞治疗业务。
值得注意的是,复星凯特在交易后将更名为复星凯瑞。复星医药表示,复星凯瑞将作为其细胞治疗技术的核心平台,继续专注于肿瘤免疫治疗领域。同时,复星凯特将纳入复星医药合并报表子公司范围。
与Kite继续合作
尽管KitePharma退出了合资企业的股权结构,但双方的合作并未就此终结。
在股权交易的同时,复星凯特与KitePharma签署了一份修订后的许可协议。根据新协议,复星凯特保留了在中国内地、香港和澳门地区独家开发、生产和商业化两款重要产品的权利:已上市的CAR-T疗法奕凯达®(阿基仑赛注射液,axicabtageneciloleucel)和在研产品FKC889(brexucabtageneautoleucel)。
奕凯达是中国首个获批的CAR-T产品,于2021年6月获批用于治疗二线及以上复发/难治性大B细胞淋巴瘤。2023年6月,该产品又获批用于一线治疗失败的大B细胞淋巴瘤患者,成为中国唯一获得二线治疗适应症的CAR-T产品。目前,奕凯达的第三个适应症——用于复发/难治性惰性非霍奇金淋巴瘤的临床试验已在中国获批。
FKC889则是复星凯特的第二款CAR-T产品,基于Brexu-Cel进行技术转移并开发。目前正在中国进行两项适应症的桥接试验:复发/难治性套细胞淋巴瘤和复发/难治性成人前体B细胞急性淋巴细胞白血病。
新的许可协议中包含了一些里程碑条款。
复星凯特需要支付1000万美元的一次性里程碑付款,外加最高2500万美元的销售里程碑付款。此外,复星凯特还需要就许可产品在许可区域内的年度净销售额支付7%-13%的特许权使用费,对于管线产品的全球销售则需支付2%-4%的使用费。
值得一提的是,协议中还设置了一个关键的时间节点:如果FKC889未能在协议签署后3年内获得中国药监局的首次注册批准,KitePharma有权终止该产品的许可。这一条款无疑会给复星凯瑞带来一定的时间压力。
复星凯特未来在中国市场将更加灵活
复星医药董事长吴以芳在谈到此次交易时表示:"自2017年与KitePharma建立战略合作以来,双方紧密携手推动了CAR-T技术及细胞治疗产品奕凯达®在中国的快速发展。复星医药坚定看好细胞治疗的发展前景,将持续推进全球领先的技术平台建设。"
复星医药执行总裁、复星凯特董事长张文杰则强调了公司未来的发展方向:"作为中国CAR-T赛道的先行者,复星凯特努力推进诊疗的范式革新,开发更多创新可能性。未来,复星凯瑞将继续坚持以未满足的临床需求为中心,竭力推动CAR-T细胞治疗产品可及可愈、惠及更多患者。"
目前,复星凯特已在全国28个省区市建立了170多家奕凯达®高标准治疗中心,并推动该产品纳入超过110款城市惠民保项目以及超过80款商业健康保险项目,大大提高了产品的可及性。公司还创新性地推出了按疗效付费的支付模式,为高值创新药品的定价和支付探索新路径。
在疗效方面,一项2023年发布的中国多中心真实世界研究数据显示,奕凯达®在中国患者中的疗效与全球数据相当,12个月总生存率高达84.3%,最佳总缓解率达83.2%,最佳完全缓解率为58.4%,且安全性更佳。
目前国内已有6家CAR-T产品获批,市场竞争逐渐激烈。
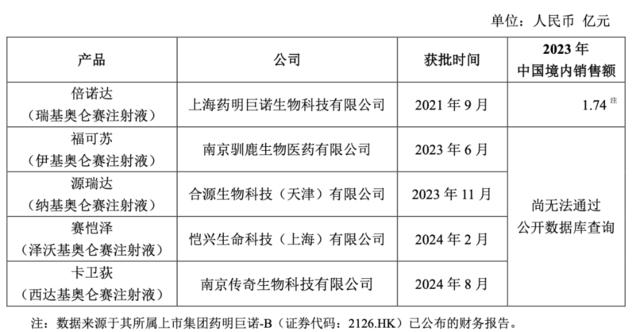
此次交易无疑将使复星医药在中国快速增长的细胞治疗市场中占据更加有利的地位。随着复星凯瑞成为其全资子公司,复星医药将能更灵活地调配资源,加速产品开发和商业化进程。
然而,挑战也随之而来:如何在没有KitePharma直接参与的情况下,保持技术创新的步伐,以及如何在日益激烈的市场竞争中保持领先地位,都将是复星医药需要面对的重要问题。
风险提示及免责条款
市场有风险,投资需谨慎。本文不构成个人投资建议,也未考虑到个别用户特殊的投资目标、财务状况或需要。用户应考虑本文中的任何意见、观点或结论是否符合其特定状况。据此投资,责任自负。
