抗体寡核苷酸偶联药物(AOC)的精确控制偶联方法
转自:药时代

前言
抗体-寡核苷酸偶联药物(AOCs)是一类由单克隆抗体和寡核苷酸(ONs)组成的新型合成生物偶联物,其在现代生物技术的应用中引起了相当大的关注。AOC已被用于开发免疫测定方法,能够检测具有高特异性和敏感性的广泛生物标志物。这些测定包括免疫PCR和邻近连接分析(PLA),它们依赖于抗体的靶标识别特性和核酸的扩增特性。最近,还开发了几种技术来利用AOC作为超分辨率成像剂,从而提高细胞成像的分辨率和对比度。
除了生物分析外,AOCs还因其通过表面受体介导的内吞作用将包括siRNA、反义RNA和CpG在内的遗传治疗有效载荷递送到靶细胞中的潜力而受到极大关注。近年来,生物制药公司将大量注意力和资源集中在开发基于AOC技术的先进药物上。如Avidity、Dyne、Tallac、Denali和GennaoBio,正在开发各种肌肉疾病的治疗方法,如1型肌强直性营养不良(DM1)、杜氏肌营养不良以及癌症和中枢神经系统疾病。Avidity的AOC1001是第一个进入临床试验的AOC,以siRNA有效载荷靶向转铁蛋白受体1(TfR1),用于治疗DM1。
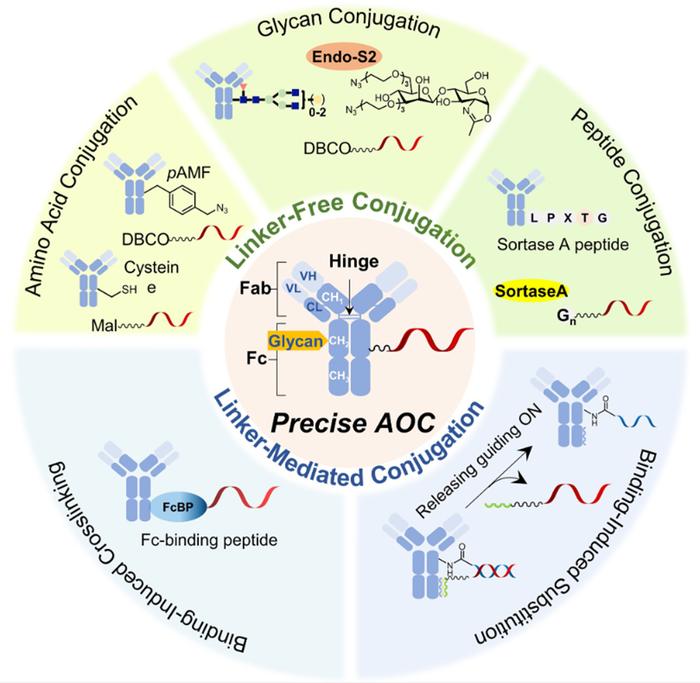
尽管AOC在临床上取得了成功,但高保真偶联技术的发展是发现AOC先导化合物的关键部分。在过去的十年里,能够精确控制AOC位点特异性和化学计量的化学和生物学方法不断进步。这些技术得以确保抗体和寡核苷酸之间的牢固且精确的连接。此外,可及性、偶联物稳定性和生产效率等参数在决定临床候选药物的成功潜力方面也发挥着至关重要的作用。

无连接子偶联法
在无连接子偶联技术中,不需要双特异性连接子作为将靶抗体连接到寡核苷酸上的粘合剂。通常,这种方法涉及对靶抗体结构的工程设计,以提供用于有效载荷ONs顺序偶联的特定生化处理。
氨基酸偶联
无连接子偶联的最常见方法包括用特定的天然或非天然氨基酸工程化靶抗体。通过引入特定的氨基酸,可以精确控制有效载荷ONs的数量和位置,半胱氨酸和谷氨酰胺是用于位点特异性偶联的两种常用氨基酸。
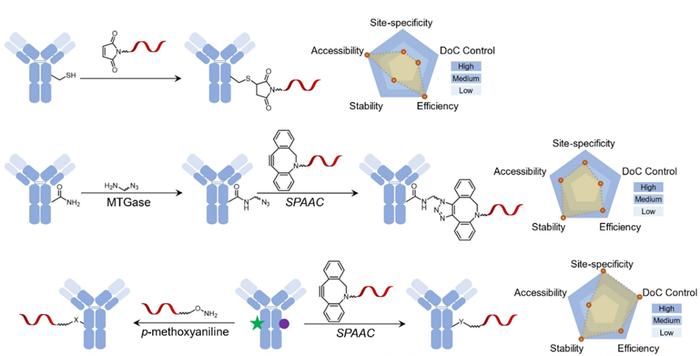
Cuellaret 等人报道了使用基于半胱氨酸的ThioMab技术将ONs共价偶联到还原的抗体上,从而促进siRNA的递送。还有人开发了一种谷氨酰胺介导的偶联方法,利用微生物转谷氨酰胺酶(mTG)将赖氨酸叠氮化物转移到靶抗体上,通过无铜点击化学偶联含有二苯并环辛烯(DBCO)的siRNA,寡核苷酸-抗体比率为2。
为了克服天然氨基酸的缺点,另一种位点特异性偶联方法是将含有反应性基团的非天然氨基酸(如叠氮基、乙酰基)引入靶抗体中。例如,在K169和S202,将对乙酰苯丙氨酸(pAcF)引入曲妥珠单抗的Fab片段中,使其与羟胺修饰的单链DNA发生肟化反应,形成AOC,然后用于检测Her2+细胞。与天然氨基酸偶联相比,非天然氨基酸偶联更稳定、更有效,然而,抗体工程也相对繁琐。此外,这些非天然氨基酸是否会在人类中引起免疫原性仍不确定。
聚糖偶联
由于IgG在Fc区的CH2或CH3区的N297处携带两条N-聚糖链,远离抗原结合区,确定连接的有效载荷ON的数量和位置相对简单。例如,具有聚糖转移活性的ENGase突变体(Endo-S,Endo-S2)可以产生具有同质聚糖结构的抗体。这种同质聚糖结构包含如叠氮化物和生物素的官能团,可以实现高效合成同质AOCs,并精确控制药物抗体比例在2至12之间。
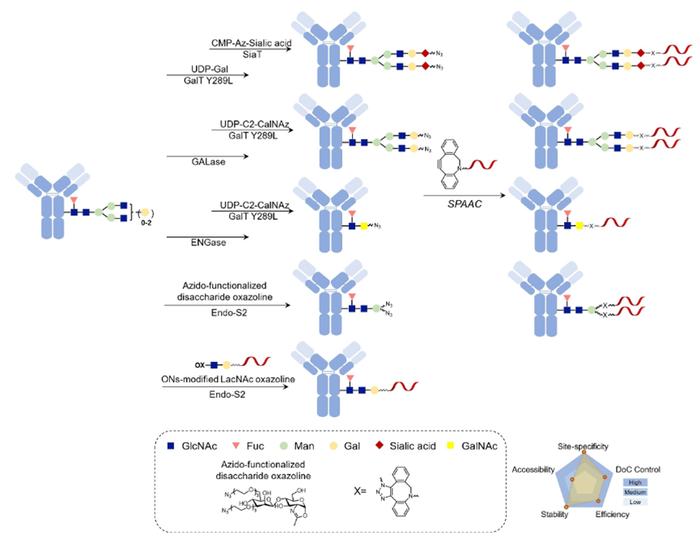
尽管聚糖结构的高度可变性可能对有效载荷的偶联产生挑战,但糖工程是一种有吸引力的天然抗体功能化生物偶联技术。然而,工程抗体生产过程相对复杂,与其他AOC制备过程相比,不能保证高生产率。
肽偶联
位点特异性偶联可以通过将ON有效载荷偶联到抗体末端的短肽标签来实现,如谷氨酰胺标签(LLQG)、SortaseA识别基序(LPETG)和SMARTag®(LCxPxR)。
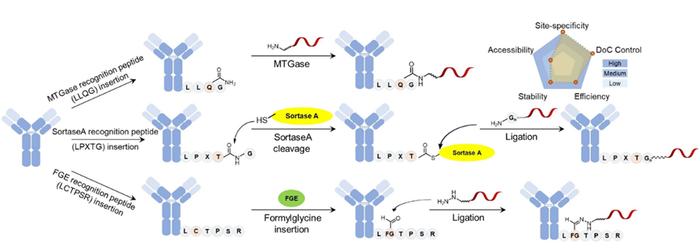
转谷氨酰胺酶能够在LLQG的谷氨酰胺侧链与其伯胺之间形成共价键;分选酶a介导的转运可以将五甘氨酸修饰的药物有效载荷转移到LPETG基序上。另一种创新的化学酶方法是SMARTag®技术平台:利用这项技术,甲酰基甘氨酸生成酶(FGE)可以将FGE识别基序(LCxPxR)中的半胱氨酸转化为甲酰基甘氨酸(fGly),抗体就可以通过醛特异性化学转化进行化学修饰,从而产生均匀稳定的偶联物。

连接子介导偶联法
尽管无连接子偶联方法比较稳健,但它仍然需要对靶抗体进行工程化或修饰,这可能会影响处理某些类型天然抗体时的性能。如果可以引入连接分子来交联靶抗体和ON有效载荷,而不是简单地修饰抗体,则可以直接从天然IgG制备精确的AOC,而不需要额外的工程。Fc结合肽(FcBPs)是用于抗体识别的最广泛使用的基序。这些肽能够特异性识别IgG的Fc片段。
结合诱导的交联
为了促进抗体和寡核苷酸之间的诱导交联,已经开发了许多高反应性基序,如光交联和化学交联试剂,以在FcBP和靶抗体之间形成共价键。几个可光活化的基团,包括二苯甲酮或马来酰亚胺苯甲酰亚胺(MBP)、苯甲酰基苯甲酸、对苯甲酰基苯丙氨酸(BPA)、光亮氨酸(pLeu)和光甲硫氨酸(pMet),已成功地整合到FcBP中。光交联的主要优点是其高特异性,这是由于激发的中间体的寿命短。这种方法的缺点是可能生成具有一个或两个标签的异质性AOC。
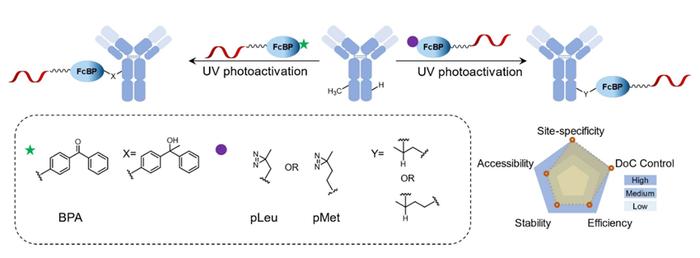
除了光交联,化学交联也可以连接氨基以产生共价AOC,如许多双功能连接子,包括SMC、DSG和SIAB等。与光交联相比,化学交联更容易且具备更好的生物相容性。然而,它的反应效率相对较低,通常需要48 小时以实现高度结合。
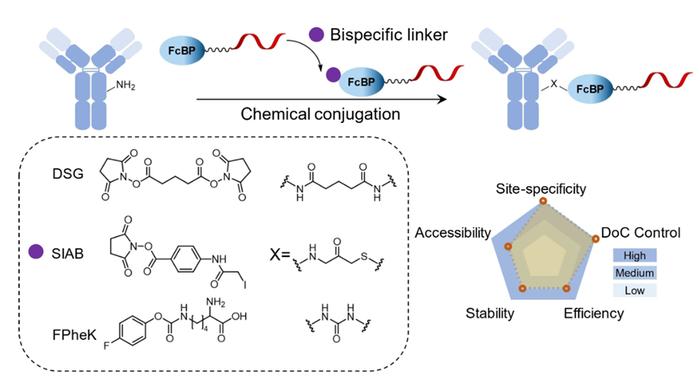
结合诱导的替代
FcBP介导的交联方法依赖于FcBP对抗体的高亲和力。然而,引入大的异源FcBP可能会引起严重的免疫原性,且抗体的性质可能会受到影响。结合诱导的替代可以通过将官能团从FcBP转移到抗体Fc片段中的特定位点(K248、N79等)来解决这个问题。FcBP用作引导剂,并且可以在抗体-寡核苷酸共价偶联后被替换或释放。
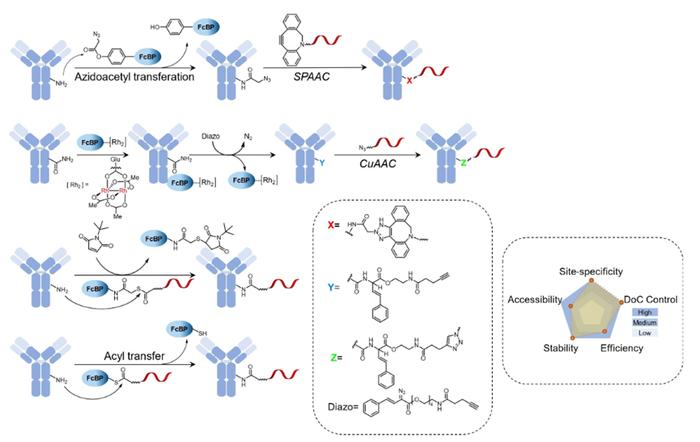
与无连接子的偶联相比,连接子介导的偶联可以更好地控制有效载荷的数量和位点特异性,而无需对抗体进行设计。在结合诱导的交联中,FcBP得以保留,使该过程更加简单有效。另一方面,结合诱导的替代避免了免疫原性和其他与FcBP相关的潜在问题,然而需要额外的制备步骤。

小结
鉴于ADC在临床上取得的巨大成功,我们坚信AOCs作为一种基因治疗递送平台具有非常光明的应用前景。在此之前,建立强有力的合成方法来产生精确的AOC将为此奠定坚实的基础。因此,有必要对AOC的药代动力学、免疫原性和疗效进行全面深入的研究。相信AOCs将在未来十年为临床应用提供光明的未来。
参考文献:
1.ChemicalBiologyApproachestowardPreciseStructureControlofIgG-BasedAntibody-OligonucleotideConjugates.Chembiochem.2023May2;24(9):e202300077
图片来源:123rf
