联拓生物宣布心肌病新药申报上市并被纳入优先审评
转自:医药观澜
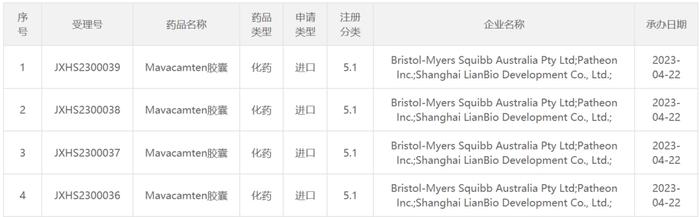
4月22日,联拓生物发布新闻稿称,中国国家药品监督管理局(NMPA)已接受mavacamten用于治疗有症状的梗阻性肥厚型心肌病(oHCM)成人患者的新药上市申请(NDA),并将其纳入了优先审评。公开资料显示,mavacamten是一种心肌肌球蛋白抑制剂,联拓生物于2020年8月获得了百时美施贵宝公司(BMS)旗下全资子公司MyoKardia的许可授权,在中国大陆、香港、澳门、台湾地区,及泰国和新加坡对该产品进行开发和商业化。
oHCM是一种慢性进行性疾病,可使心壁增厚,使心脏难以正常扩张并充满血液,导致多种衰弱症状和心脏功能障碍,该疾病也是年轻人心脏骤停的常见原因。造成oHCM最常见的原因是肌节的心肌蛋白发生突变。在oHCM患者中,血液离开心脏的左心室流出道(LVOT)被增厚的心肌阻塞。因此,该病也与房室颤动、卒中、心力衰竭和猝死的风险增加有关,急需新疗法来治疗患者。
据联拓生物公开资料介绍,肥厚型心肌病的机理特征是过量的肌球蛋白-肌动蛋白横桥的形成和超松弛状态的失调。Mavacamten作为一款创新的口服选择性心肌肌球蛋白抑制剂,靶向oHCM的潜在病理生理学,它能将整体肌球蛋白群转变到节能、可募集的超松弛状态,有望减少患者的心脏过度收缩症状。在临床研究和临床前研究中,mavacamten可以降低心壁应激的生物标志物,减轻过度的心肌收缩力,减少左心室流出道梯度和增加舒张顺应性。
此前,mavacamten已在美国获批用于治疗症状性纽约心脏协会(NYHA)心功能II-III级的梗阻性肥厚型心肌病(oHCM)成人患者,以改善功能能力和症状。这款产品还先后获FDA授予突破性疗法认定,以及在中国被纳入突破性治疗品种,用于治疗oHCM患者。此外,该药也在澳大利亚、加拿大和巴西获得了监管部门的上市批准。

此次mavacamten新药上市申请在中国的递交是基于全球关键3期EXPLORER-HCM临床试验的结果。试验结果证明该产品在有症状的oHCM患者中具有较好的疗效,在运动能力、功能状态和患者报告结局以及缓解左心室流出道梗阻的能力方面可为患者带来具有临床意义的改善。EXPLORER-HCM试验达到了其预先设定的所有主要和次要研究终点,且具有统计学意义。
该NDA还包括联拓生物在中国健康志愿者中开展的1期药代动力学研究的临床数据。该研究证明了mavacamten的安全性、耐受性以及与在美国开展的1期药代动力学研究中观察到的相似的药代动力学特征。此外,联拓生物在有症状的oHCM中国患者中正在开展的3期双盲EXPLORER-CN试验的初步安全性数据,也被用以支持该NDA的递交,这项试验的顶线数据预计将于2023年中期公布。
参考资料:
[1]中国国家药品监督管理局药品审评中心(CDE)官网.RetrievedApr 22,2023from https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
[2]联拓生物宣布中国国家药品监督管理局已接受Mavacamten用于治疗有症状的梗阻性肥厚型心肌病的新药上市申请并将其纳入优先审评.RetrievedApr22,2023,fromhttps://mp.weixin.qq.com/s/TtRDG_fdtyLJpRF5AmUjZQ
