CDE文章 | 2017 年至 2021 年中国儿童血友病药物临床试验分析
转自:注册圈

摘要
目的分析2017年至2021年国内儿童血友病药物临床试验的登记情况及血友病治疗药品在中国上市情况。方法检索国家药品监督管理局“药物临床试验登记与信息公示平台”和“药品查询”数据库,获得儿童血友病临床试验注册信息及血友病治疗药品的上市信息,进,进行分类统计。结果平台共登记了42项包含儿童受试者的血友病药物临床试验,国内制药企业研发的试验药物以血源性凝血因子42.86%,18项/42项为基础,研发趋势为重组型凝血因子30.95%,1,13项/42项,国际制药企业以重组型凝血因子及非因子产品为主。申办者、研究者对于临床试验的保险意识及投保积极性很高,重,重视临床试验的风险控制,特,特别是受试者的保障。血友病药物临床试验注册在地域上存在较大的不均衡性,与主要研究者的学术水平、临床试验经验、专业权威及医疗机构的技术水平密切相关。目前有31家国内外生产企业的3种类型的血友病治疗药品在中国获准上市。结论目前国内制药企业已研发上市的血源性凝血因子减轻了血友病患者的经济负担,为实施标准的预防治疗提供了可能性。长效重组凝血因子及非因子产品的研发是目前血友病研发及治疗的趋势。
血友病hemophilia是一种罕见病,是X染色体连锁的隐性遗传性出血性疾病,可分为血友病A凝血因子Ⅷ缺乏和血友病B凝血因子Ⅸ缺乏两种临床表现以关节、肌肉、内脏和深部组织自发性或轻微外伤后出血难止,常在儿童期起病,反复关节出血导致患儿逐渐出现关节活动障碍而残疾。血友病的发病率没有种族或地区差异。所有血友病患者中,血友病A占80%~85%,血友病B占15%~20%。女性血友病患者极其罕见[1]。凝血因子替代疗法是目前血友病患者的主要治疗手段,而临床试验既是血友病药物研发的关键环节,又是血友病治疗药物上市的必经之路。本研究基于国家药品监督管理局“药物临床试验登记与信息公示平台”和“药品查询”数据库,汇总分析我国2017年至2021年开展的儿童血友病药物临床试验及获批上市的血友病治疗药品,旨在了解我国血友病药物研发的现状及趋势,为我国血友病药物的研发热点及研发方向提供最新的参考资料。
01
材料、对象与方法1
1.1资料来源
从国家药品监督管理局药品审评中心“药物临床试验登记与信息公示平台”,以“血友病”病”“h“hemophilia”为关键词进行筛选,检,检索血友病药物临床试验登记的相关信息另外,从国家药品监督管理局“药品查询”系统查询血友病治疗药品的上市信息,检,检索时间均为2017-01-01———2—2021-12-31。研究对象年龄包含<18岁受试者的临床试验项目。
1.2项目筛选及资料提取
由2名研究者独立筛选,提取资料并交叉核对,如有分歧,通,通过讨论协商解决。按照上述纳入与排除标准筛选项目,记录纳入临床试验的基本资料试验题目名称、申请人名称、组长单位、试验药物名称、药物类型、试验分期、设计类型、盲法、试验范围、性别、年龄、数据安全监查委员会、购买药物临床试验保险等情况。由2名研究者独立筛选,从国家药品监督管理局“药品查询”系统查询治疗血友病药品的上市信息,记录药品的具体信息药品名称、商品名、来源、公司名称、批准日期、注册证号、规格/瓶、国家/地区等信息。
1.3数据整理及统计分析
用Excel软件录入,整理数据。用SPSS25.0软件对资料进行统计分析,定性资料采取频数、构成比描述。
02
结 果
2.1研究筛选流程及结果
检索“药物临床试验登记与信息公示平台”共获得52项关于血友病注册的临床试验,逐条查看注册信息,最终纳入包含儿童受试者的血友病药物临床试验注册项目42项检索“药品查询”系统,共纳入31家药品生产企业关于血友病治疗药品的上市信息。
2.2一般资料
2017年至2021年登记的11649项药物临床试验中,涉,涉及儿童血友病药物注册临床试验项目有42项0.36%,4,42项/11649项),试验设计多为单臂开放性研究试验药物类别多为生物制品,设置数据安全监查委员会的项目有5项11.90%,5,5项/42项),均为国际制药企业发起,未,未设置数据安全监查委员会的项目有37项88.10%,3,37项/42项);为受试者购买药物临床试验保险的项目有41项97.62%,4,41项/42项),未购买药物临床试验保险的项目有1项2.38%,1,1项/42项。
42项儿童血友病药物注册临床试验项目中,国内制药企业发起的临床试验有31项73.81%,3,31项/42项),国际制药企业发起的临床试验有11项26.19%,1,11项/42项),研,研究范围涉及国际多中心药物临床试验项目有7项16.67%,7,7项/42项),国内试验有35项83.33%,3,35项/42项);临床试验项目所处试验分期以Ⅲ期为主80.95%,3,34项/42项),国内制药企业研发的试验药物以血源性凝血因子为基础42.86%,1,18项/42项),研,研发趋势为重组型凝血因子30.95%,1,13项/42项),国际制药企业以重组型凝血因子及非因子产品为主,见表1
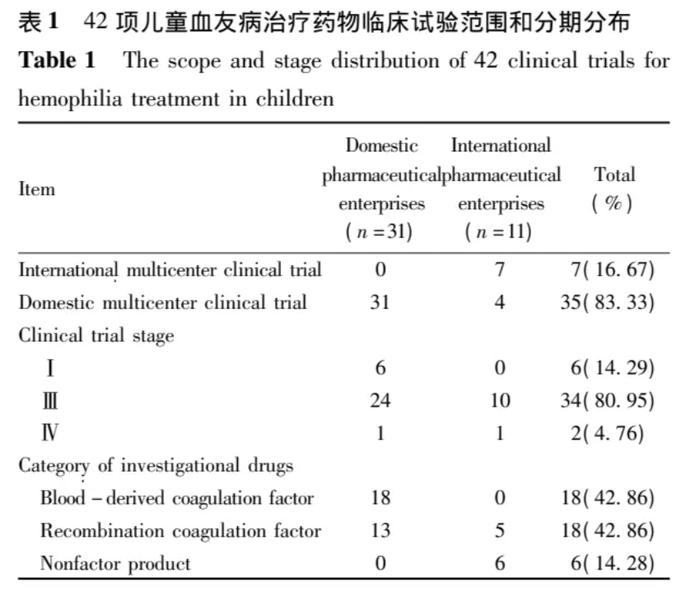
2.3临床试验项目适应症及试验药物类别分布
在登记的42项儿童血友病药物临床试验项目中,适,适应症为血友病A的项目有28项,适,适应症为血友病B的项目有9项,适,适应症包含血友病A及血友病B的项目有5项。根据试验药物的来源,涉及血源性凝血因子项目18项,重,重组型凝血因子项目18项及非因子产品项目6项,具,具体分布见表2。

2.4药物临床试验组长单位
42项儿童血友病药物临床试验项目涉及14家组长单位,其,其中牵头临床试验数量居前5位的单位依次是中国医学科学院血液病医院20项、首都医科大学附属北京儿童医院3项、河南省肿瘤医院3项、济南市中心医院3项、南方医科大学南方医院3项。这5家组长单位牵头的临床试验项目共32项,占比76.19%32项/42项。5在中国获准上市的血友病治疗药品2017年至2021年共有31家国内外制药企业的3种类型的血友病治疗药品在中国获准上市。已上市的治疗血友病A的国内制药企业有12家38.71%,1,12/31),其,其中11家上市产品为血源性凝血因子,1,1家上市产品为重组型凝血因子治疗血友病A的国际制药企业有7家22.58%,7,7/31),其中6家上市产品均为重组型凝血因子Ⅷ,1家上市产品为非因子产品。已上市的治疗血友病B的国内制药企业有12家38.71%,1,12/31,上市产品均为血源性凝血因子、国际制药企业有1家上市产品为重组型凝血因子Ⅸ。
03
讨论
血友病治疗药品第1代产品主要是血源凝血因子,代,代表产品有血源Ⅷ、血源Ⅸ,其特点是来源于血浆提取物,上游血浆采集量决定药物产量,不足之处是每周注射次数多,原料不易获取,存在血源性病毒传染的风险[2]在国内已上市的第2代产品是重组凝血因子及长效重组凝血因子,代表产品有重组Ⅷ、重组Ⅸ,其,其优点是避免血源病毒传染的可能性,摆脱了对血浆的依赖,通,通过PEG修饰、Fc融合蛋白、白蛋白融合蛋白等技术[3],产品的半衰期延长1倍以上,提高了患者治疗的顺应性,免疫原性明显降低[4],缺点是难以避免抑制物的产生,还可能引起静脉炎。在国内已上市的第3代产品主要是非因子产品,代表产品有艾美赛珠单抗注射液,还,还有组织因子途径抑制剂靶向疗法、抗凝途径抑制剂[3-5],其优点是可以促进足够的凝血酶产生,恢复凝血因子内源性产生的可能性,缺点是价格昂贵。国际制药企业已上市产品主要是第2代、第3代。

我国制药企业对罕见病的研发热情逐步高涨近年来,国家和社会对罕见病的关注度越来越高,国家已出台的一系列罕见病保障措施,如《第一批罕见病目录》2018年、《罕见病诊疗指南2019年版》《罕见疾病药物临床研发技术指导原则》2022年),力图逐步解决罕见病群体在诊疗、用药可及和可支付上的难题,激,激发了药企开发罕见病药物的热情。在罕见病研发申报产品中,血友病治疗药物可谓“一枝独秀”,不,不仅数量多,而,而且规格丰富。从已登记的的临床试验项目来看,国内制药企业研发的试验药物以血源性凝血因子为基础42.86%),正在积极布局重组型凝血因子30.95%的研发,且临床试验项目所处试验分期以Ⅲ期为主,有,有望更多的国产药品早日上市。
药物临床试验保险购买情况本研究中为受试者购买药物临床试验保险的项目达41项97.62%),虽然我国药物临床试验责任保险起步较晚,但随着我国医药水平的发展,行,行业内对于购买临床试验保险来转移风险的意识越来越强,从投保比例来看,目前整体行业的保险意识及投保积极性很高[6]。申办者、研究者重视临床试验的风险控制,特别是受试者的保障。
血友病药物临床试验项目组长单位分布情况我国血友病药物临床试验项目牵头单位前5位分别为中国医学科学院血液病医院、首都医科大学附属北京儿童医院、河南省肿瘤医院、济南市中心医院、南方医科大学南方医院。提示我国血友病药物临床试验注册在地域上存在较大的不均衡性,与主要研究者的学术水平、临床试验经验、专业权威及医疗机构的技术水平密切相关。
凝血因子种类变迁及非因子产品的开发凝血因子有两种制备方法传统的血液提取法和基因工程重组生产法。血浆来源的凝血因子有可能存在血源性病毒人类免疫缺陷病毒、肝炎病毒等污染,且产量受原料血浆的限制另一种是基因重组技术,应用聚乙二醇结合、人免疫球蛋白Fc片段等结合的长效凝血因子,半,半衰期明显延长和免疫原性明显降低,将成为未来应用的主要产品。
非因子类产品的上市彻底改变了血友病A替代治疗模式。艾美赛珠单抗是一种双特异性单克隆抗体,通,通过模拟FⅧa的辅因子功能,可同时桥接FⅨa和FⅩ,使,使FⅩ在没有FⅧ的情况下得以继续激活,重新恢复天然的凝血通路。该药在国内已获批用于血友病A合并FⅧ抑制物患者的常规预防治疗[4]。该药物作用时间长,只需每周皮下注射给药一次,是我国目前唯一上市的长效非因子类产品。研究人员正在开发多种其他类型的治疗药物,如组织因子途径抑制剂靶向疗法、抗凝途径抑制剂RNAi抗凝血酶疗法、以期为产生抑制剂的血友病患者提供更多治疗选择。治愈血友病的最佳途径是基因治疗,全球范围内的研究正在积极进行中,在,在动物实验研究中取得了重大突破,但,但仍需进一步证实其安全性以最终应用于临床,血,血友病基因治疗产品有望在未来十年内上市[3,7,7]。
血友病替代治疗的实施血友病是先天性疾病,治疗需持续终生。目前的治疗以替代治疗为主,包括按需治疗与预防治疗。原则是早期、足量、足疗程[8]。我国血友病患者数量多,且进口药品价格昂贵,存在未满足的预防治疗空间和经济负担。随着国家药品监督管理机构一系列改革措施的持续推进以及我国经济和医疗条件的改善,血,血友病治疗格局已发生了很大变化,国内制药企业已研发上市的血源性凝血因子实现了国产化的替代,为血友病预防治疗提供了可能性,多,多数国内制药企业在已生产血源性凝血因子的前提下,积,积极布局第2代凝血因子的研发,进一步减轻血友病患者的经济负担。
目前儿童血友病患者的预防治疗已实现医保覆盖,血,血源性人凝血因子Ⅷ在医保甲类目录中、重组人凝血因子Ⅷ在国家医保乙类目录中,可供儿童预防治疗使用。
鼓励国际多中心临床试验进一步开展42项儿童血友病药物注册临床试验项目中,涉及国际多中心药物临床试验项目有7项16.67%),均由国际制药企业发起,试验药物均为新的治疗方法如组织因子途径抑制剂靶向疗法、抗凝途径抑制剂疗法。按照中共中央、国务院对深化药品审评审批制度改革的有关精神,国家药品监督管理局继续对治疗罕见病的药品和防治严重危及生命疾病的部分药品优化审评程序,确保我国患者早日用上境外已上市新药,同时促进我国血友病药物研发热情和提高药物治疗的整体水平。
本研究基于国家权威数据库,系统分析我国儿童血友病药物临床试验及上市血友病治疗药物的情况,结果显示,目前国内制药企业已研发上市的血源性凝血因子减轻了血友病患者的经济负担,为实施标准的预防治疗提供了可能。长效重组凝血因子及非因子产品的研发是目前血友病研发及治疗的趋势。
参考文献
[1]国家卫生健康委员会办公厅.关于印发罕见病诊疗指南2019年版的通知[EB/OL].北京国家卫生健康委员会办公厅,2019-02-27[2022-02-10].http//www.nhc.gov.cn/yzygjgj/s7659/201902/61d06b4916c348e0810ce1fcfceb844333.shtml.
[2]中华医学会血液学分会血栓与止血学组,中国血友病协作组.血友病治疗中国指南2020年版)[J].中华血液学杂志,2,2020,414265-271.
[3]张威,毛,毛建华.血友病A治疗研究新进展[J].中华血液学杂志,2018,3,39183-86.
[4]国家卫生健康委办公厅.儿童血友病诊疗规范2019年版[J].全科医学临床与教育,2,2020,1,1814-9.
[5]孙博洋,杨仁池. 血友病治疗新进展[J].中华血液学杂志,2018,3,3910873-876.
[6]孙健,薛,薛瓮云,曹,曹丽君.我国药物临床试验为受试者提供保险的调查与分析[J].临床药物治疗杂志,2,2019,1,17382-85.
[7]代新岳,张磊.血友病基因治疗研究进展[J].中华血液学杂志,2018,3,394350-352.
[8]中华医学会血液学分会血栓与止血学组,中国血友病协作组儿童组,中华医学会儿科学分会血液学组.中国儿童血友病专家指导意见2017年)[J].中国实用儿科杂志,2,2017,3,3211-5.
