盘点 | 2021年全球十大畅销药品(上)
随着全球跨国药企2021年Q3财报的公布,2021年前三季度全球畅销药物TOP10榜单出炉。
2021年前三季度,全球畅销药TOP10销售额高达986.78亿美元,较2020年同期增长54.84%。值得注意的是,2021年前三季度TOP10的上榜门槛为47亿美元,较2020年同期增长20.51%,逼近50亿美元关卡,预估2021年TOP10的上榜门槛将突破70亿美元。
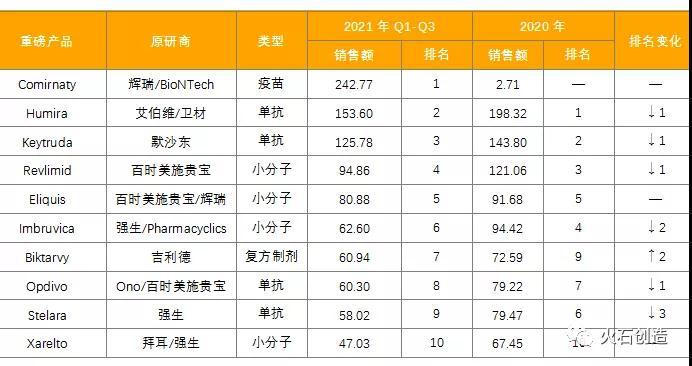
“一进一出”“三甲”异位,辉瑞新冠mRNA疫苗稳坐榜首。与往年相比,2021年全球畅销药TOP10榜单整体变动不大,“一进一出”即辉瑞新冠mRNA疫苗入榜,拜耳Eylea(阿柏西普)出局。排名前三位的产品分别为辉瑞/BioNTech—Comirnaty(新冠mRNA疫苗)、艾伯维/卫材—Humira(阿达木单抗注射液)、默沙东—Keytruda(PD-1/L1抑制剂)。其中,占据榜首的Comirnaty成为业界关注的焦点。除首次上榜外,Comirnaty创下“销售额首次突破200亿美元大关的药品、超越雄踞榜首多年的Humira、上榜药物中上市时间最短的药品”等多个突破性记录,预估其2021全年销售额将突破260亿美元。
从疾病领域来看,抗肿瘤药物占比高达40%,心脑血管药物占比30%,抗病毒药物占比20%,自身免疫疾病药物占比10%。从药品类型来看,分布趋于平衡,化学药和生物药各占一半,超百亿品种均为生物药。从排名变化来看,抗体药物的排名均有不同程度的下降。从原研厂家所属地域来看,榜单几乎被美国制药公司垄断。
表1:2021年全球畅销药TOP10
Comirnaty
通用名:BNT162b2
商品名:Comirnaty
原研商:辉瑞/BioNTech
适应症:预防16岁及以上人群的新冠病毒感染性疾病
上市时间:中国获批—2020年;EMA—2020年;FDA—2021年
新冠疫情改写了竞争格局,BNT162b2首次入榜,挤掉雄踞榜首多年的Humira。放眼全球,BNT162b2已获得加拿大、以色列、英国等超70个国家和地区的卫生监管部门授权使用,已在全球范围内供应超10亿剂,2021年上半年营收113亿美元。在美国,除BNT162b2外,还有2款新冠病毒疫苗可供使用,分别是Moderna的mRNA疫苗“mRNA-1273”和强生的病毒载体疫苗“JNJ-78436735”,市场竞争较为激烈。其中,Moderna在BNT162b2之后获得FDA紧急使用授权;强生的病毒载体疫苗更易储存和运输,可在普通冷冻温度下保存。随着疫情在全球持续蔓延,全球十余个国家已发布新冠疫苗加强针计划,疫苗需求将随之增大。
Humira
通用名:Adalimumab-阿达木单抗
商品名:Humira-修美乐®
原研商:艾伯维/卫材
适应症:溃疡性结肠炎、葡萄膜炎、银屑病、儿童克罗恩病、化脓性汗腺炎、类风湿关节炎、强直性脊柱炎、克罗恩病、银屑病关节炎、幼年型类风湿性关节炎、斑块银屑病
上市时间:FDA—2002年;EMA—2003年;中国获批—2010年
Humira多年占据全球畅销药物榜首。作为全球首个获批上市的全人源化抗肿瘤坏死因子α(TNF-α)的单克隆抗体,自上市以来,Humira累计销售额近1500亿美元,在全球获得批准的适应症已超过15个,累计超过100个国家和地区至少批准其一个适应症。
随着其在欧美专利保护到期,Humira即将面临全球仿制药的激烈竞争。在美国,Humira专利将于2023年到期。自2017年9月以来,艾伯维先后与安进、勃林格殷格翰、辉瑞、山德士等多个药企签署Humira生物类似药协议。预计2023年以后,艾伯维将面临首批美国仿制药竞争,届时至少9款生物类似药进入美国市场,其销售额或将面临大幅下滑。在欧洲地区,Humira于2018年10月专利到期,届时至少6款生物类似药获批上市。根据EvaluatePharma预测,到2026年,Humira全球销售额将下降到68.3亿美元。
在中国,由于Humira市场售价高,尚未进入国家医保药品目录,销售额并不亮眼。国内多家龙头企业瞄准其未来的市场和发展潜力,如海正药业、复星医药、步长制药、华兰生物等龙头企业积极布局Humira生物类似药,市场竞争十分激烈。其中,百奥泰的格乐立、海正生物的安健宁、信达生物的苏立信、复宏汉霖的汉达远,均已获得国家药监局批准上市。作为国内首个获批的阿达木单抗生物类似药,格乐立于2020年1月正式上市销售,其2020年营业收入达1.8亿元。
Keytruda
通用名:Pembrolizumab-帕博丽珠单抗
商品名:Keytruda-可瑞达®
原研商:默沙东
适应症:三阴乳腺癌、非小细胞肺癌、肾细胞癌、肝细胞癌、黑色素瘤、头颈癌、经典霍奇金淋巴瘤、转移性结直肠癌等
上市时间:FDA—2014年;EMA—2015年;MHLW—2016年;中国获批—2018年
Keytruda是一种抗PD-1疗法,通过阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞,被业内称之为“K药”。作为全球第二款获批上市的PD-1药物,Keytruda自上市以来已获批超20项肿瘤适应症,成为多种类型肿瘤临床治疗的基石。目前正开展的1400余项临床试验中,与其他肿瘤治疗途径结合的临床试验超过1000余项。作为PD-1/L1抑制剂的领头羊,Keytruda有望于2025年登顶全球畅销药榜首,预计全球销售额将突破220亿美元。
Keytruda主要的市场竞争对手为全球首款PD-1抑制剂“Opdivo”,业内称其为“O药”。在PD-1药物上市销售之初,“O药”遥遥领先,销售额超“K药”近2倍。随着临床试验的推进,“O药”和“K药”相继启动用于非小细胞肺癌一线治疗的Ⅲ期临床研究。其中,默沙东于2016年6月率先公布“K药”到达临床终点,而“O药”未到达临床终点。自此,“K药”开启逆袭之路,2018年的全球销售额反超“O药”,并持续保持强劲增长态势。
在美国,受FDA专利补偿制度保护,Keytruda的专利保护将持续到2028年;在欧洲和中国,Keytruda的专利保护同样持续到2028年。对此,默沙东正通过组合疗法等形式,以期延长Keytruda的专利期限。
当前,我国已经成为PD-1产品开发竞争最为激烈的市场之一,国内已有6个PD-1产品获批上市,预计未来2-3年将达到15个。此外,齐鲁制药、海正药业、复宏汉霖、信达生物、百济神州、甘李药业等多家龙头企业均已布局PD-1生物类似药。
Revlimid
通用名:来那度胺
商品名:Revlimid
原研商:百时美施贵宝
适应症:多发性骨髓瘤(MM)、骨髓增生异常综合征(MDS)、套细胞淋巴瘤(MCL)
上市时间:FDA—2005年;PMDA—2010年;中国获批—2013年
Revlimid是一种免疫调节剂,其活性成分来那度胺(Lenalidomide)是沙利度胺的新一代衍生物,具有免疫调节、抗血管生成和抗肿瘤特性。Revlimid已获批5个适应症,成为全球销售额最高的一款多发性骨髓瘤药物。Revlimid源自Celgene,百时美施贵宝在2019年以740亿美元收购Celgene。在百时美施贵宝2020年的肿瘤药业绩贡献中,Revlimid全年销售额达121亿美元,成为其肿瘤药板块中贡献最高的药物。
Revlimid在美国的专利保护期持续到2022年3月。在百时美施贵宝收购Celgene之初,Revlimid即处在专利风暴之中。近年来,百时美施贵宝先后与4家制药公司(Natco、Alvogen、Dr.Reddy、SunPharma)达成和解协议,即在获得FDA批准的前提下,4家制药公司可在2022年3月之后生产和销售数量有限的Revlimid仿制药。该协议的所有限制将于2026年1月31日结束,届时可自由销售“无限量”的Revlimid仿制药。2021年10月19日,Dr.Reddy宣布FDA批准其Revlimid的仿制药申请(ANDA),并获得180天的仿制药独占期。放眼国内,也有多家龙头企业取得Revlimid仿制药生产批件。其中,北京双鹭药业的Revlimid首仿药“立生”于2017年11月上市,并于2020年6月通过仿制药一致性评价;正大天晴的Revlimid仿制药“安显”于2019年1月上市,齐鲁制药和扬子江药业的来那度胺胶囊以新分类方式获批上市,视同通过仿制药一致性评价。
Eliquis
通用名:Apixaban-阿哌沙班
商品名:Eliquis-艾乐妥®
原研商:百时美施贵宝/辉瑞
适应症:预防接受择期髋关节或膝关节置换术的成年患者出现静脉血栓栓塞症事件
上市时间:EMA—2011年;FDA—2012年;PMDA—2012年;中国获批—2013年
作为全球第三个上市的新一代口服抗凝剂,Eliquis自十年前上市以来,销售额增速迅猛,并于2017年反超由拜耳和强生联合开发的Xarelto,成为全球最畅销抗凝血药物。目前,Eliquis已在40余个国家和地区获批。根据EvaluatePharma预测,2024年Eliquis的全球销售额将达到113亿美元。
Eliquis在全球抗凝血药物市场中的高速成长和亮眼表现吸引了众多仿制药企业。多年来,百时美施贵宝和辉瑞一直在努力对抗仿制药竞争对手,2家公司在2017年对25家已向FDA提交Eliquis仿制药上市申请的公司提起专利侵权诉讼。同年8月,美国专利商标局授予Eliquis一项关键组合物专利,将其保护期延长至2026年11月。此外,Eliquis的另一项配方专利保护期将于2031年到期。目前,FDA已暂时批准2款Eliquis仿制药。江苏豪森的阿哌沙班首仿药于2019年获得国家药监局批准,此后国内龙头企业如正大天晴、科伦药业、齐鲁制药等的仿制药陆续上市。当前,受专利保护,Eliquis仿制药上市尚需时日。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
