官方通知 | 5连发 !关于《已上市药品说明书增加儿童用药信息工作程序 (试行)》等通知
转自:注册圈
NO.1
为完善已上市药品说明书儿童用药信息,提升儿童安全用药水平,国家药品监督管理局组织制定了《已上市药品说明书增加儿童用药信息工作程序(试行)》,现予发布。
本公告自发布之日起施行。
特此公告。
国家药监局
2023年5月29日



NO.2
根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)的规定,经国家药品监督管理局组织论证和审核,甲硝唑氯已定洗剂(浓)由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。
请相关药品上市许可持有人在2024年2月29日前,依据《药品注册管理办法》等有关规定,向省级药品监督管理部门提交修订说明书备案,并将说明书修订内容及时通知相关医疗机构、药品经营企业等单位。
非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。药品上市许可持有人提交备案之日起生产的药品,不得继续使用原药品说明书。
特此公告。
2.非处方药说明书范本
国家药监局
2023年5月30日



NO.3
各省、自治区、直辖市中医药主管部门、药品监督管理部门:
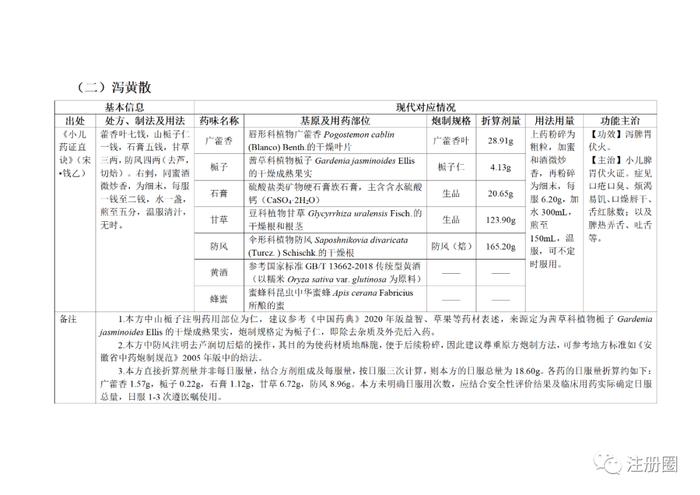
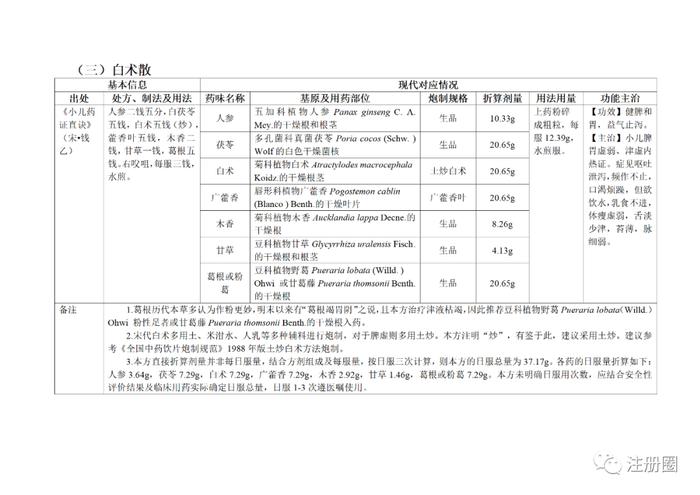
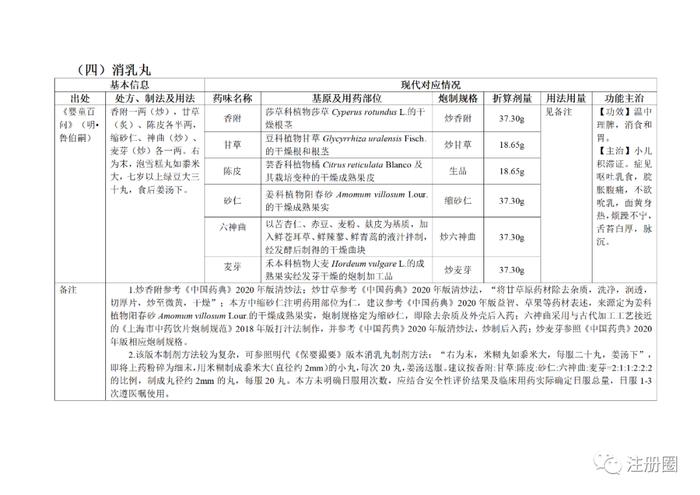
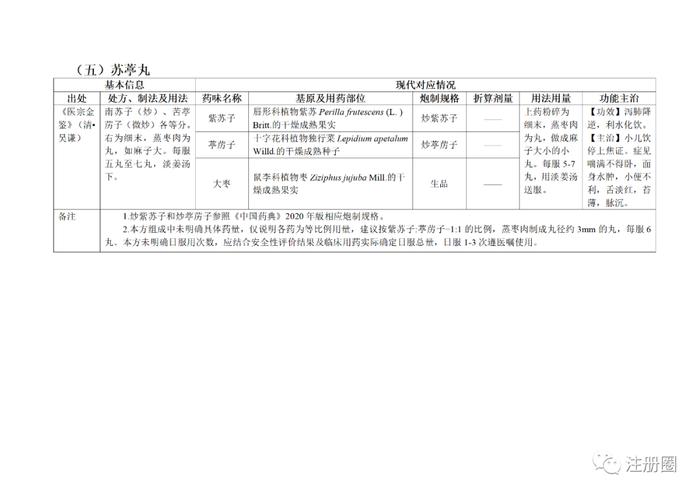
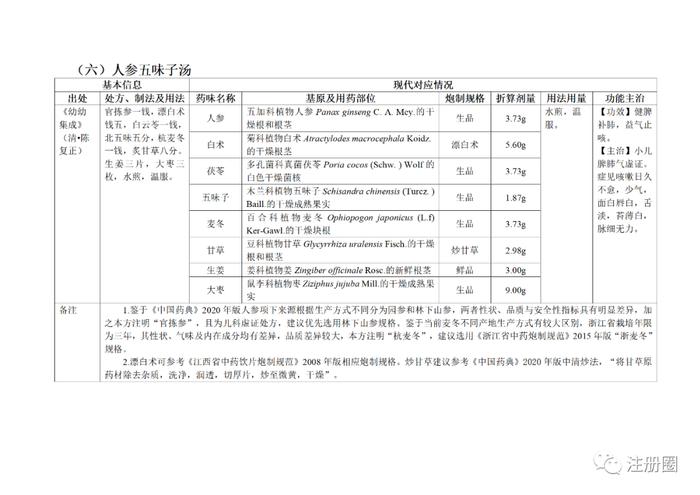
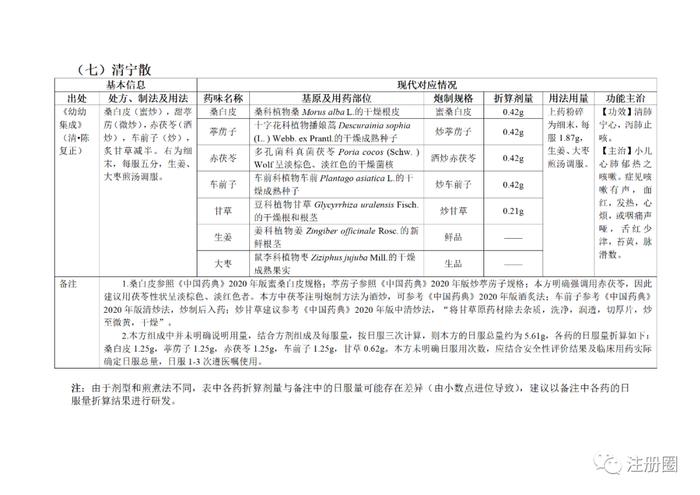
为贯彻落实《中医药法》《中共中央国务院关于促进中医药传承创新发展的意见》,加快推动古代经典名方中药复方制剂上市,更好发挥中医药特色优势,满足人民群众用药需求,国家中医药管理局、国家药品监督管理局积极组织推进古代经典名方关键信息考证研究工作,现将《古代经典名方关键信息表(“异功散”等儿科7首方剂)》予以公布。
国家中医药管理局综合司 国家药品监督管理局综合司
2023年5月5日
NO.4


为加强业界对细胞和基因治疗产品研发的理解,提升我国细胞和基因治疗产品研发水平和效率,5月24日,由药审中心指导,药品长三角分中心主办,高研院承办的“细胞和基因治疗产品临床研发技术指导原则”主题线上培训会成功举办。来自药品监管机构、制药企业和研发机构共6000余人参加培训。
此次培训由药审中心生物制品临床部部长高晨燕、副部长鲁爽以及黄云虹、高建超、刘晓、赵晨阳、刘妍彤等5位资深审评员,围绕《免疫细胞治疗产品临床试验技术指导原则(试行)》、《嵌合抗原受体T细胞(CAR-T)治疗产品申报上市临床风险管理计划技术指导原则》等进行了详细解读。各位专家还就企业在研发过程中遇到的难点及相关问题进行了有针对性的解答。

近年来,细胞治疗和基因编辑等技术蓬勃发展,其中长三角区域内相关产业发展相对集中,从事细胞与基因治疗产品的研发企业和开展临床试验的数量占全国的50%以上。下一步,药审中心将推进监管科学研究,加快制订细胞基因治疗指导原则,积极服务细胞和基因治疗产业高质量发展。
NO.5

5月24日,由药审中心和药品大湾区分中心联合主办的化学新药药学沟通交流培训会在广东省深圳市成功举办。粤港澳大湾区药品监管机构、医药企业和研发机构的代表等约300余人现场参会。
本次培训会邀请药审中心化药药学一部部长王亚敏及周浩辉、刘永辉、马春辉3位资深审评员,围绕加强化药新药药学沟通交流、助力新药创新发展,新药临床试验申请(IND申请)前药学沟通交流、新药Ⅲ期临床试验前药学沟通交流、新药上市申请(NDA申请)前药学沟通交流等内容进行了宣讲,并结合具体案例作了讲解。在交流讨论环节,还对企业在创新药研发中遇到的共性问题及技术要求进行了详细解答。
与会代表在会后表示,此次培训会加深了企业和研发机构对化药新药临床和上市申请的认识,内容充实、解读到位,有利于更好地推动大湾区化药创新药研发和申报工作,助推大湾区医药产业高质量发展。

