Nature重磅:个性化胰腺癌疫苗,在初期临床试验中取得惊人疗效
转自:药时空
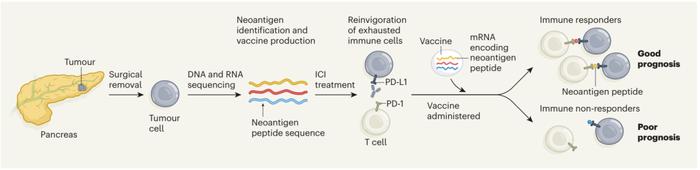
胰腺导管腺癌(PDAC)是导致癌症相关死亡的主要类型之一,虽然手术可以治愈部分PDAC患者,但即使给予额外的化疗,绝大多数患者最终仍会复发并死亡。
PDAC通常对免疫检查点抑制剂具有耐药性,不过最近的研究表明,PDAC常常包含免疫原性新抗原,这些新抗原可以作为疫苗接种的靶点。
基于此,Rojas和Sethna等人利用手术切除的PDAC样本,基于mRNA-脂质体纳米颗粒平台,设计了制造和递送个性化新抗原靶向疫苗的治疗策略。近日,该项目第一阶段研究的结果以题为“PersonalizedRNAneoantigenvaccinesstimulateTcellsinpancreaticcancer”的研究论文发表在知名学术杂志Nature上。

在这项临床试验中,Rojas等人招募了34名PDAC患者,其中28人接受了手术。手术后6周,19名患者接受单剂量的Atezolizumab(抗PD-L1,阿特佐珠单抗)治疗;3周之后,16名患者接受多达8次的个性化自体基因Cevuman疫苗的启动剂量注射,该疫苗含有编码每个患者多达20个新抗原的mRNA。随后,15名接种疫苗的患者接受了mFOLFIRINOX治疗,这是一种改良版的四药化疗方案,包括亚叶酸、氟尿嘧啶、伊立替康和奥沙利铂。数名患者还接受了后期的加强剂量的疫苗注射。所有参与患者都在纪念斯隆凯特琳癌症中心接受治疗和监测。
在安全性方面,19例接受Atezolizumab治疗的患者没有发生3级以上的不良事件(AE),16例患者中只有1例在接种自源性Cevuman疫苗后发生了3级AE。所有患者均有1级和2级AE,但总体而言该治疗被证明在人体中是可耐受的。
接下来,研究人员致力于解决可行性问题。研究人员在基准时间的3天内(手术后中位数为9.4周)制造了自源性的Cevuman疫苗并给患者接种。只有一名患者没有足够的抗原用于疫苗生产。16例患者中,有3例由于疾病进展、死亡或mFOLFIRINOX毒性而未接种全部的9剂疫苗。
为了测量疫苗诱导的T细胞反应,Rojas等人使用体外IFNγELISpot测定,发现在8/16的患者中,自体基因Cevuman疫苗诱导了新的高强度新抗原特异性T细胞,这些患者被认为是应答者。在所有患者中,研究人员均检测到230种新抗原中至少对25种有反应,其中4例患者显示出对多种新抗原的反应。
为了进一步评估疫苗诱导的T细胞反应,研究人员开发了CloneTrack工具。这是一种通过比较治疗前后外周血T细胞受体(TCR)Vβ测序,来鉴定T细胞克隆扩增和丰度的工具。
研究人员随后将该系统用于可评估的患者样本,在8例ELISpot应答者和8例无应答者中,分别鉴定出8例和1例疫苗诱导的克隆扩增。在每个应答者中均鉴定出多个扩增克隆 (中位数为7.5),占血液T细胞总数的10%。当将CloneTrack分析应用于 Atezolizumab 治疗前后收集的样本时,Atezolizumab治疗后的扩增克隆和疫苗扩增克隆之间没有重叠。
sc-RNAseq分析显示,疫苗诱导高强度扩增的T细胞克隆,主要是CD8+T细胞,并表达效应功能标记物,包括穿孔蛋白1(perforin1)、颗粒酶B(granzymeB)和干扰素γ(IFNγ)。在接种疫苗后的样本中,CD8+T细胞被发现具有多功能性,并且在体外实验中可以再攻击表达新抗原和MHC-I限制性最小表位的靶细胞,并产生IFNγ和颗粒酶B;而 CD4+T细胞没有表现出这种特性。
当患者在术后46周接受疫苗增强剂治疗时,先前通过启动剂量扩增的克隆在所有接受增强剂的应答者中出现再次扩增。扩增的T细胞群包括多功能的新抗原特异性效应CD8+T细胞。尽管患者同时接受了mFOLFIRINOX治疗,但体内的T细胞在抗原刺激下仍保持产生IFNγ的能力。
此外,疫苗诱导扩增的T细胞克隆表现出长期的持久性,在手术后长达2年的时间里,仍占血液T细胞总数的2.5%。
在中位期为18个月的随访期间,自体基因Cevumeran疫苗的应答者比无应答者的中位无复发生存期(RFS)更长(未达到vs.13.4个月)。通过将RFS与在所有8次疫苗启动剂量中无复发的患者的反应相关联,研究者排除了反应时间偏差。应答者血清中的 PDAC临床生物标志物CA19-9的血清表现出持续性的低水平。
为了确定是否在已经预后较好的患者中疫苗反应更好,研究人员观察了各种临床因素,包括对Atezolizumab的反应,淋巴结阳性,边缘阳性,原发肿瘤大小,化疗剂量的数量和肿瘤内CD8+T细胞的密度,但研究者没有发现这些变量与疫苗反应相关。应答者和无应答者也具有相似的免疫适应性,外周固有免疫细胞和适应性免疫细胞的频率相似,这与SARS-CoV-2RNA疫苗的应答相似。
为了寻找应答的相关因素,Rojas等人研究了疫苗诱导应答与肿瘤克隆性和新抗原质量之间的关系。使用结合新表位与已知免疫原性表位和自身表位关系的算法评估质量。应答者始终比无应答者有更多的克隆肿瘤,并且他们的肿瘤含有具有高质量特征的新抗原,这些新抗原与能够引发T细胞IFNγ应答的疫苗新抗原相关。
在一名有反应的患者中,研究人员观察到血清CA19-9的增加,这与该患者体内7mm肝脏病变的出现相吻合。研究者怀疑该患者出现了肝转移,不过随后对病变部位的活检表明,该病变并不包含肿瘤细胞,而只是一个密集的淋巴样细胞聚集。其中包含该患者的所有15个疫苗诱导扩增的CD8+T细胞克隆,这显示出溶解和效应潜力的证据。研究人员还发现了一些携带TP53R175H突变的罕见恶性细胞,这与患者原发肿瘤中的R175H驱动的突变相同。该病变在随后的影像学检查中消失,提示免疫介导的潜在微转移的消除。
总的来说,该试验成功地达到了安全性、可行性、疫苗诱导的新抗原特异性T细胞的诱导,以及佐剂型自体疫苗个体化接种18个月无复发生存期的终点。与抗PD-L1和mFOLFIRINOX的联合使用,表明这种治疗方法在PDAC患者中可诱导强烈的肿瘤特异性反应并延迟了肿瘤复发。总之,该研究将为改善这种致命恶性疾病的预后提供新的希望。
参考文献:Rojas,L.A.,Sethna,Z.,Soares,K.C.etal.PersonalizedRNAneoantigenvaccinesstimulateTcellsinpancreaticcancer.Nature618,144–150(2023).https://doi.org/10.1038/s41586-023-06063-y
