推荐阅读 | 药物开发各阶段之CMC研究关键点
转自:注册圈
CMC(ChemistryManufacturing&Control)是药物申报中非常重要的部分,其始于通过药物发现确定一个先导化合物,并贯穿于药物开发全生命周期的所有阶段。
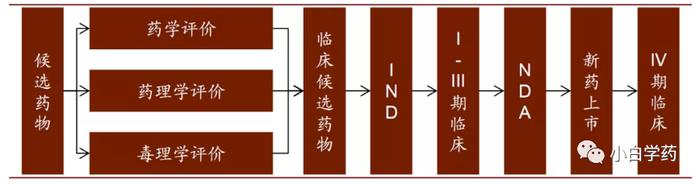
药物研发时间长、投入大、风险高。药物开发流程主要包括:靶点确定、discovery、临床前药学研究(IND)、临床实验(临床I、II、III期)、NDA/BLA、上市。
CMC研究主要包括生产工艺、杂质研究、质量研究及稳定性研究等。不同阶段的CMC研究重点均有所不同。
在临床前和早期临床研究阶段,CMC研究主要是为以上研究提供质量有保证的研究用样品。在新药临床试验申请中对CMC申报要求,应有足够的资料证明应试药物的性状、质量,纯度和剂量。在IND中需要有一个部分用以描述原料药和制剂的组成,生产和质量控制。
随着临床研究的推进,CMC研究则致力于生产工艺以及质量控制体系。
并结合临床对剂型、规格、处方工艺、分析方法、质量标准等进行调整优化。
监管机构对于CMC研究要求主要基于:临床研究的阶段、受试者的数量和研究周期、药物结构和作用机制的新颖性、剂型和给药途径、已暴露和潜在的风险等。
创新药物CMC和仿制药物CMC要点并不同的,创新药物研发过程具有不确定性,其剂型、规格和处方,需结合毒性、有效性进行变更,以达到毒性最低、疗效最佳。
创新药物的研发是具有阶段性,各阶段CMC研究要点也不相同。
药物研究工作主要可分为:研究阶段(临床前研究、Ⅰ期临床研究)、全面开发阶段(Ⅱ期临床研究、Ⅲ期临床研究)、上市申请阶段和上市后阶段。
临床前研究
一个药物分子经过早期的靶点研究确定(工作的起点)、分子设计、初步评价,筛选与合成先导化合物,通过体外细胞试验验证,初步筛选出活性高、毒性低的化合物,并进行结构优化,获取候选化合物后,进入临床前研究。
包括药理、药效、毒理、药代、药动等成药性的评价。其中CMC以提供确切的试验样品为主,打通工艺、质量初步可控。
验证性临床I期、II期研究CMC研究主要在于保证药物质量的可控性和一致性。
I期临床研究:考察其成药性、剂量效应以及安全性。
对于I期临床,安全性是研发和评价的核心。药学审评重点为安全性相关问题,如杂质、稳定性、无菌制剂的生产条件和灭菌/除菌方法等。
在临床前研究、Ⅰ期临床研究,淘汰率较高。I期临床研究中患者较少、周期较短,CMC的研究主要保证药物质量的可控性。在稳定性研究中,保证I期临床研究的质量稳定,保障药物的安全性。
该阶段明确结构和性质,药物剂型和处方均可能变化,规格未明确。剂型和处方设计在保证安全性的前提下需保证制剂质量一致、杂质可控。制备充足样品供药理毒理和临床研究,以及CMC的研究。此外对药品质量更好的控制,并进行稳定性考察。
Ⅱ期临床试验是在Ⅰ期临床试验之后进行的第二个阶段。主要目的是进一步评估新药物或治疗方法的疗效和安全性。这个阶段的样本规模通常会较大一些,涉及到相应疾病的患者。试验可能会包括对照组,用来比较新药物或治疗方法与标准治疗的疗效。
确证性临床III期研究
III期临床试验属于临床试验的治疗作用确证阶段,通过III期临床试验证明新药对目标适应症患者是安全有效的,其受益/风险比是可以接受的,为药物申报注册提供充分的依据,同时还为药品说明书和医生处方提供充分的数据。
通过扩大受试者的规模,对药物安全性和疗效进行全面的研究,为药物安全性、有效性的确证阶段。
该阶段对CMC的详细研究,为申报阶段准备相关的资料,以供上市审批用。
受试者规模扩大,对化合物的安全性和疗效进行全面研究,是对药物安全性、有效性的确证阶段。此阶段的CMC研究可能涉及对药物的剂型、处方、规格进行变更或优化,以达到降低毒性、提高疗效等目的。
经过此阶段的研究,关键工艺参数,药物的处方工艺应基本确定。确定各工序关键工艺参数、明确工艺验证和商业化初期的生产批量等。
需要进行全面的质量研究工作,同时根据药物的特性、处方和工艺的情况制定药物的质量控制标准,在工艺验证前应在GMP条件下完成方法学验证。
此阶段应对药物的稳定性进行全面的研究,确选定适宜的包装和规格,以确定药物的贮藏条件和有效期/复验期。
3期申报的批量不一定与上市保持一致;验证批次应与上市保持一致,或接近上市。
上市申请及上市后阶段上市申请,CMC研究需提供全套完整的CMC研究信息,研究工作应参考已发布的各项指导原则开展。
CMC研究的最终目标是要保证上市药品的质量可控,对于上市申请,确定稳定、重现、可商业化生产的工艺,构建完善的药品质量控制体系。
提供研究信息说明如何构建质量控制体系,对于所确定质量控制体系的合理性和全面性的论证。
在CDE的药品技术审评实践中,在CMC审评中,若发现研究中的欠缺,应在进行研究时予以关注,包括BCS分类,晶型、粒度的选择,灭菌工艺条件,稳定性研究等。
药品批准上市后,应对生产工艺开展持续工艺验证或再验证。此外,药品的处方、生产工艺、生产批量、分析方法或质量标准、生产厂商或生产场地/车间、原辅料的来源、工艺设备等诸方面均可能会发生相应的变更。
2022年10月,FDA发表了《化药、仿制药和生物制品获批后CMC变更的可比性方案》指南终稿,为药物上市后的CMC变更申请提供了一种解决途径。
不同研发阶段,CMC研究的目的不同,CMC研究的广度和深度要与所处药物研发阶段相适应,保证有充分的研发数据支持风险评估和风险控制,不跨越研发阶段,过早完成过多的药学工作。
对于研究进程中的变更,要依据变更的程度、变更的阶段,开展相应的验证工作,评估变更前后样品质量的可衔接性。
CMC,是整个药物开发的基石,各阶段研究工作均不容有失。
