论文分享|北京化工大学首篇Cell,揭示噬菌体抑制和逃逸细菌CBASS免疫系统的分子机制
转自:诺唯赞生物
论文分享▼
Vazyme
search
x
基本信息
x
文章题目:BacteriophagesinhibitandevadecGAS-likeimmunefunctioninbacteria
发表期刊: Cell
影响因子: 66.85
发表日期: 2023-02-16
作者及单位: 北京化工大学博士研究生曹雪利与美国加州大学旧金山分校博士研究生ErinHuiting为本文的共同第一作者,北京化工大学生命学院冯越教授和加州大学旧金山分校JosephBondy-Denomy教授为通讯作者。
Vazyme合作产品:
FastPure GelDNAExtractionMiniKit (Vazyme#DC301,胶回收/DNA纯化试剂盒)
FastPure PlasmidMiniKit(Vazyme#DC201,质粒DNA小提试剂盒)
2×Phanta MaxMasterMix(Vazyme#P515,高保真DNA聚合酶)
2×RapidTaqMasterMix(Vazyme#P222,快速PCR扩增酶)
x
研究背景
x
CBASS(Cyclicoligonucleotide-BasedAnti-phageSignalingSystem)是原核生物中的一种基于环状寡核苷酸的抗噬菌体信号系统,与CRISPR相关系统类似,是细菌的一种免疫防御系统。CBASS系统由环状GMP-AMP合酶(cGAS)和下游蛋白效应分子组成,这些效应蛋白可杀死被噬菌体感染后的细菌或抑制细菌生长,阻止噬菌体增殖,从而保护整个细菌群体[1,2]。
同时,噬菌体也采用多种策略来对抗细菌的免疫系统。已知噬菌体可编码多种蛋白质以抑制宿主免疫系统,如CRISPR-Cas和限制性修饰系统,但尚不清楚噬菌体是否有抑制或逃逸CBASS免疫系统的机制。
x
论文概述
x
本研究筛选出一种具有天然功能性的CBASS免疫系统菌株,并结合生物化学、结构生物学等多种手段,发现菌株中内源性类cGAS酶在噬菌体感染期间产生3',3'-cGAMP,向磷脂酶效应物发出信号,限制噬菌体复制;作为响应,噬菌体通过表达抗CBASS蛋白Acb2,吸附并隔离3',3'-cGAMP,有效地破坏CBASS系统的免疫作用。另外,Acb2的缺失会使CBASS系统阻断噬菌体的复制和溶原诱导,但少数噬菌体会通过主要衣壳基因的突变来逃避CBASS系统的免疫作用。
该研究证实了内源性CBASS抗噬菌体的免疫功能,并揭示了噬菌体抑制和逃逸CBASS免疫系统的分子机制。
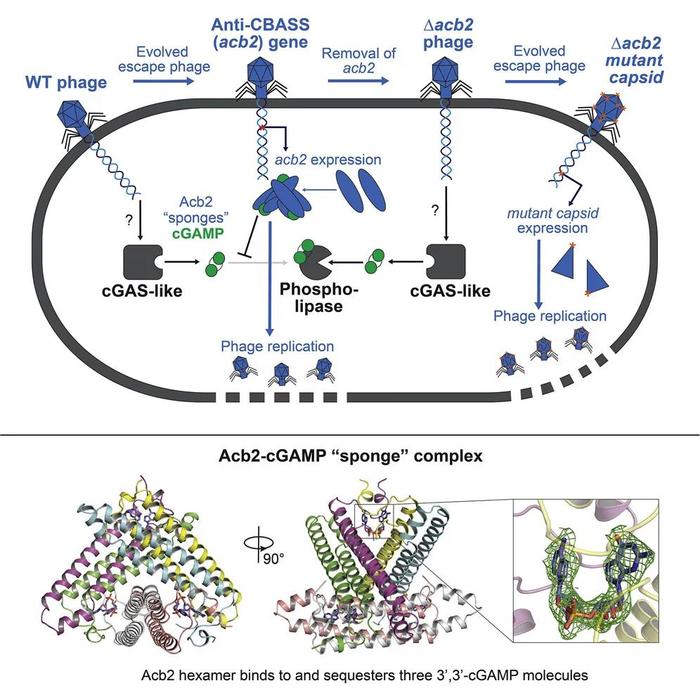
(图片来自原文)
x
研究思路及成果
x
1.筛选具备CBASS免疫功能的菌株及功能验证
通过生物信息学分析,研究人员首先筛选出252株存在CBASS免疫的不同铜绿假单胞菌菌株(图2A,B),使用CRISPR-Cas技术将四种常见CBASS类型代表菌株的CBASS基因座敲除(图2C),最终筛选出一种具有天然功能性的CBASS免疫系统的菌株P.aeruginosa(BWHPSA011;Pa011)(图2D,E)。
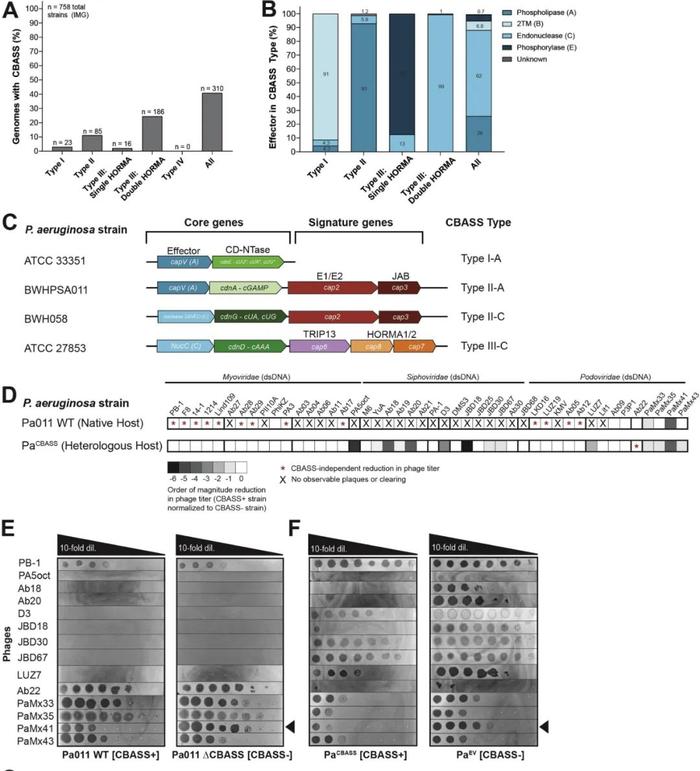
为确定CBASS系统发挥作用所必需的基因,研究人员通过特定突变体的构建发现capV、cdnA和cap2的突变使抗噬菌体活性消失。利用ELISA技术发现,被PaMx41噬菌体感染的菌株产生的3',3'-cGAMP在CdnA突变株中几乎检测不到(图3)。所以,面对PaMx41噬菌体感染,该菌株可能通过类cGAS酶(CdnA)产生3',3'-cGAMP,激活磷脂酶(CapV)效应蛋白,从而限制噬菌体复制。
(图片来自原文)
2.分析噬菌体逃逸CBASS免疫作用的分子策略
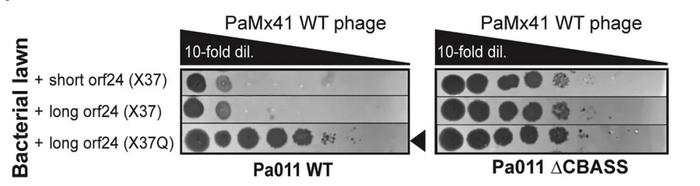
通过对10株逃逸CBASS免疫的噬菌体进行全基因组测序,研究人员发现所有噬菌体中存在一个突变:orf24中的无终止延伸突变(X37Q)。X37Q将gp24蛋白从37个氨基酸延长到94个。并且,在CBASS免疫系统存在的情况下,长gp24(Acb2)使PaMx41噬菌体的滴度提高了4个数量级以上(图4),说明Acb2抑制Pa011菌株的CBASS免疫作用。
(图片来自原文)
3.确定Acb2在免疫逃逸过程中的作用机制
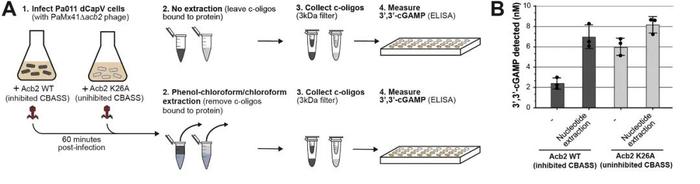
研究人员将Acb2进行纯化,尝试与纯化的CapV、CdnA、Cap2等物质结合,发现Acb2仅直接与3',3'-cGAMP分子结合(图5B),并使CapV磷脂酶活性消失(图5A)。此前已证实CapV磷脂酶活性仅可被3',3'-cGAMP激活,说明Acb2通过与3',3'-cGAMP结合和隔离减少相关信号分子来抑制CBASS免疫。
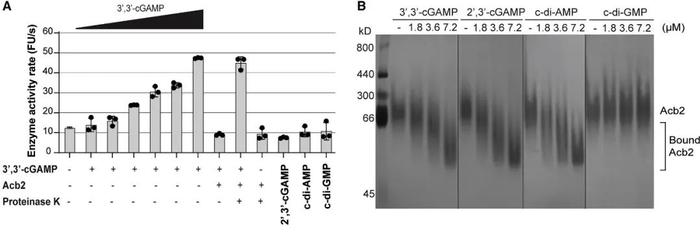
(图片来自原文)
研究人员测定了Acb2蛋白及其结合3',3'-cGAMP的复合物晶体结构,结构显示Acb2蛋白自身为一个紧凑的六聚体,可在单体N端的“口袋”中结合3个3',3'-cGAMP分子(图6)。另外,经过一系列体内体外实验,发现Acb2可以广泛抑制各类型CBASS免疫。
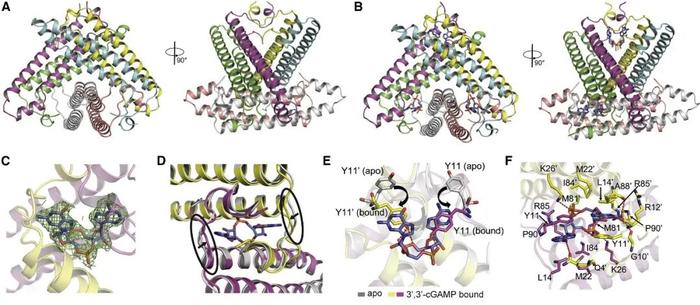
(图片来自原文)
最后,研究人员还对其他逃逸CBASS免疫作用的替代机制进行了分析,发现少数噬菌体会通过主要的衣壳基因的突变来逃避CBASS系统的免疫作用。综上,本文证实了内源性CBASS系统的抗噬菌体免疫作用,并提出了噬菌体抑制和逃逸CBASS系统免疫的有效策略。
x
Vazyme产品支撑
x
x
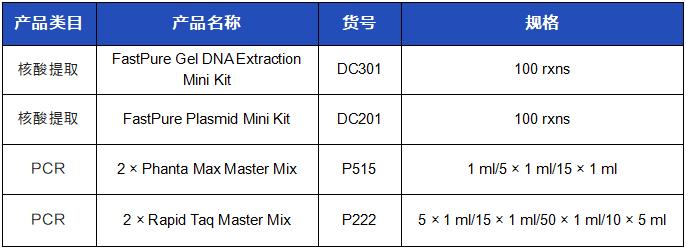
相关产品订购信息
x
【参考文献】
[1]Lowey,Brianna,etal."CBASSimmunityusesCARF-relatedeffectorstosense3′–5′-and2′–5′-linkedcyclicoligonucleotidesignalsandprotectbacteriafromphageinfection."Cell 182.1(2020):38-49.
[2]Cohen,Daniel,etal."CyclicGMP–AMPsignallingprotectsbacteriaagainstviralinfection."Nature 574.7780(2019):691-695.
