速递 | 有望成为首个!辉瑞近1亿美元推进的疫苗公布积极2期临床结果
转自:药明康德
近日,Valneva公司和辉瑞(Pfizer)共同宣布,其莱姆病(Lymedisease)候选疫苗VLA15在作为加强剂接种时获得了积极的儿童和青少年免疫原性和安全性数据。这些来自2期临床试验VLA15-221的结果显示,儿童(5至11岁)和青少年(12至17岁)以及成人(18至65岁)在接种加强剂量一个月后(第19个月)对所有血清型都产生了强烈的抗原抗体反应。

莱姆病是一种人类因受蜱虫叮咬而导致伯氏疏螺旋体菌(Borreliaburgdorferi)进入人体,引起系统性感染的疾病。莱姆病被认为是北半球最常见的虫媒传染病,据预估全世界有约14.5%的人口受到感染。此疾病的早期症状不明显,容易被忽略或误诊。若不经治疗,此疾病将会扩展至全身,引发出现在关节、心脏、神经系统的严重并发症。
VLA15是一种在研的多价蛋白亚单位疫苗,靶向伯氏疏螺旋体的外表面蛋白A(OspA)。拮抗OspA蛋白可以避免伯氏疏螺旋体离开其宿主蜱虫而感染人类。此疫苗涵盖了六种在北美与欧洲最常表达于伯氏疏螺旋体上的OspA血清型。2017年7月,美国FDA授予VLA15快速通道资格。截至目前,VLA15在临床前和临床研究中均表现出了强大免疫反应和令人满意的安全性。
Valneva公司与辉瑞公司于2020年4月达成合作协议,共同开发VLA15,并于2022年6月对协议条款进行了更新,向Valneva注入约9500万美元的资金推进莱姆病项目的3期临床试验开发。新闻稿指出,目前还没有获得批准的莱姆病人类疫苗,VLA15的3期研究已在进行中,是目前临床开发中进展最快的候选疫苗。
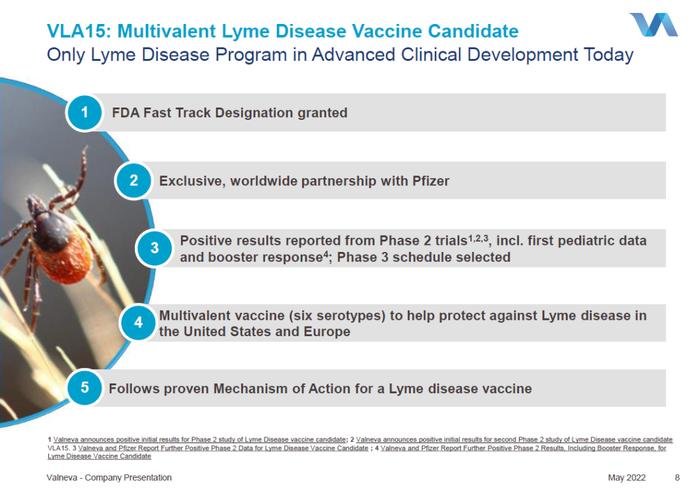
VLA15-221是一项随机、观察者盲、安慰剂对照的2期研究,并且是第一项以儿童为研究对象的VLA15临床研究。此次公布的结果显示,根据所接受的主要接种计划(0-2-6个月或0-6个月)的不同,受试者在接受加强剂后,所有年龄组的所有OspA血清型的血清转换率(SCR)为95.3%和94.6%。此外,与初次给药后一个月相比,加强剂给药后1个月所有血清型的OspA抗体滴度显著更高,成人抗体滴度增加3.3至3.7倍(几何平均倍数增加),青少年抗体滴度增加2.0至2.7倍,儿童抗体滴度增加2.3至2.5倍。
该2期临床试验的结果表明,VLA15具有为儿童和青少年群体提供莱姆病免疫力的潜力。儿童和青少年接种强化剂一个月后的几何平均滴度(GMT)同样很高。
VLA15加强剂接种后的安全性和耐受性与之前的研究结果一致,所有年龄组的接种者都能很好地耐受该候选疫苗,而不受主要接种计划的影响。独立的数据安全监测委员会(DSMB)未发现与疫苗相关的严重不良事件(SAE)和安全问题。
2022年8月,辉瑞和Valneva启动了目前正在进行的3期临床试验,以探索VLA15在美国和欧洲高流行地区5岁及以上受试者中的疗效、安全性和免疫原性。第二项3期研究也在进行中,旨在进一步证明VLA15在儿童人群中的安全性。
辉瑞的目标是在获得积极的3期研究数据后,于2026年向美国FDA提交生物制品许可申请(BLA),并向欧洲药品管理局(EMA)提交上市许可申请(MAA)。
参考资料:
[1] ValnevaandPfizerReportPositivePediatricandAdolescentPhase2BoosterResultsforLymeDiseaseVaccineCandidate.RetrievedSeptember8,2023,fromhttps://valneva.com/press-release/valneva-and-pfizer-report-positive-pediatric-and-adolescent-phase-2-booster-results-for-lyme-disease-vaccine-candidate/
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
