“临床应用指导原则”落地,新型抗肿瘤药物不能随意超适应证使用
转自:医药经济报
日前,国家卫健委发布了《新型抗肿瘤药物临床应用指导原则(2023年版)》(以下简称2023年版《指导原则》),旨在进一步规范新型抗肿瘤药物临床应用,提高肿瘤治疗的合理用药水平,保障医疗质量和医疗安全,维护肿瘤患者健康权益。
2018年9月,我国首版《新型抗肿瘤药物临床应用指导原则》由国家卫健委组织国家卫健委合理用药专家委员会编制发布。自首版问世后,国家卫健委定期组织进行更新及发布,成为目前国内肿瘤医生、患者治疗用药参考最全面的“标杆指南”之一。
2023年版《指导原则》强调,合理应用抗肿瘤药物是提高疗效、降低不良反应发生率以及合理利用卫生资源的关键。首先,抗肿瘤药物临床应用需考虑药物可及性、患者治疗意愿、疾病预后和用药安全性等四大要素。其次,判断抗肿瘤药物临床应用是否合理应基于以下两方面:有无抗肿瘤药物应用指征,以及安全性、有效性、经济性及适宜性的综合考量。需要明确的是,《指导原则》中涉及的新型抗肿瘤药物是指小分子靶向药物和大分子单克隆抗体类药物等。
2023年版有哪些新增?
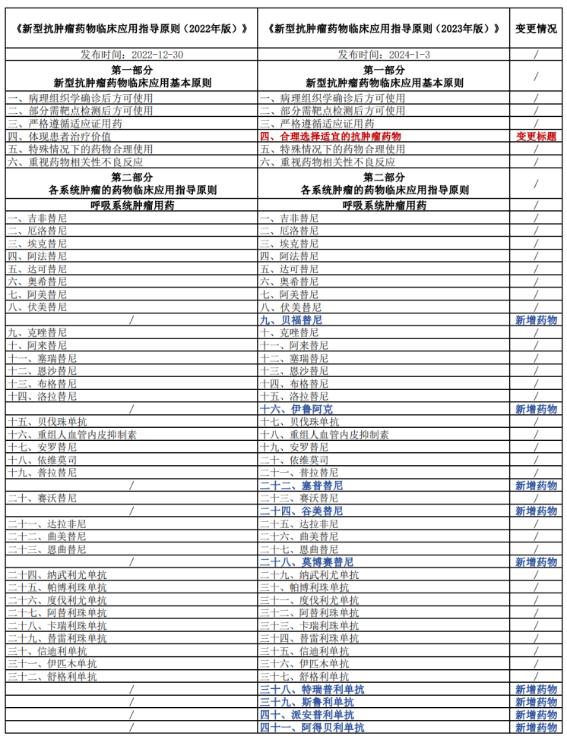
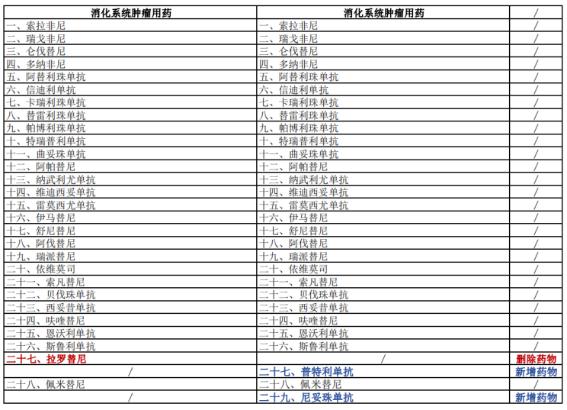
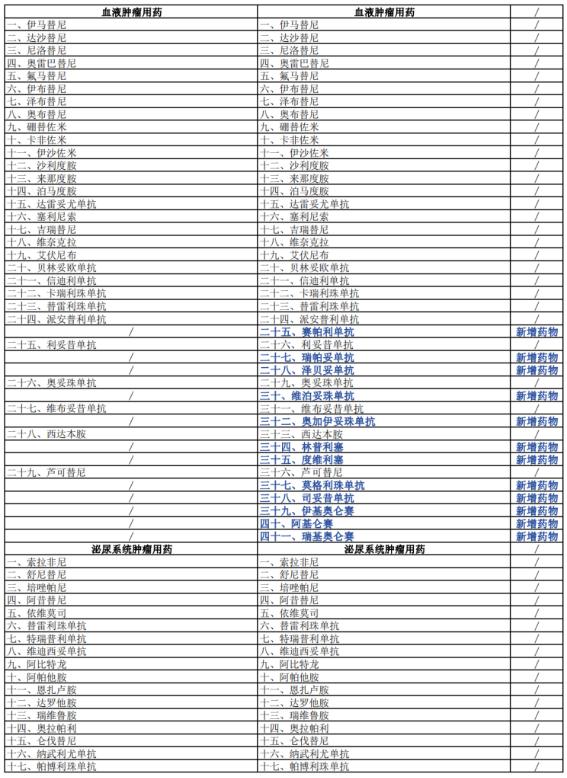
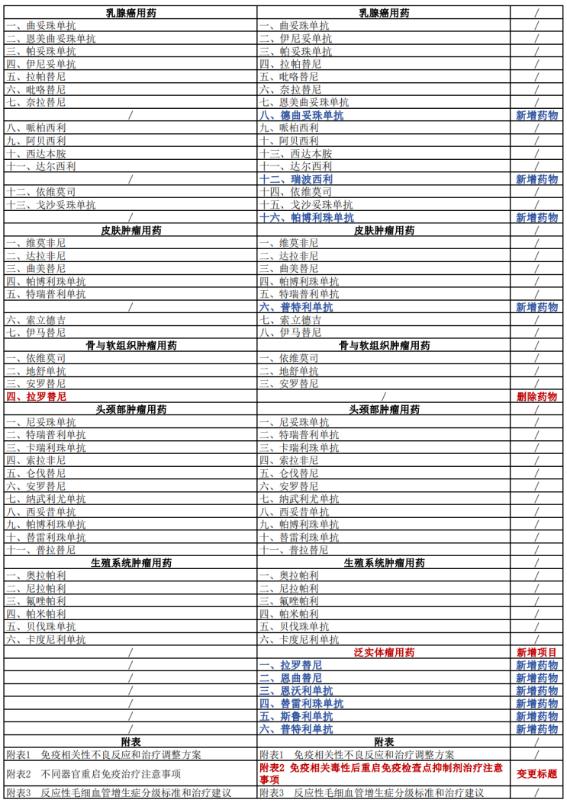
据了解,2023年版《指导原则》在2022年版基础上进行了更新完善,新增了部分药物,更新了部分药物的适应证或合理用药要点。其中,2023年版《指导原则》的第一部分临床应用基本原则中的“体现患者治疗价值”一章变更为“合理选择适宜的抗肿瘤药物”;且新增了33种新型抗肿瘤药物(含同一药物拓展适应证):呼吸系统肿瘤用药由2022年版的32种增加到41种,消化系统肿瘤用药由28种增加到29种,血液肿瘤用药由29种增加到41种,乳腺癌用药由13种增加到16种……另外,对照2022年版《指导原则》删除了拉罗替尼在消化系统和骨与软组织肿瘤用药的2项适应症,并纳入泛实体瘤用药范畴。
具体变更情况详见下表:
多款产品靶点检测要求变更
随着靶向药物种类增多,未经基因检测盲目试用的现象有所增加,这不仅违背了科学用药的原则,而且也无法让患者得到最大的临床获益。
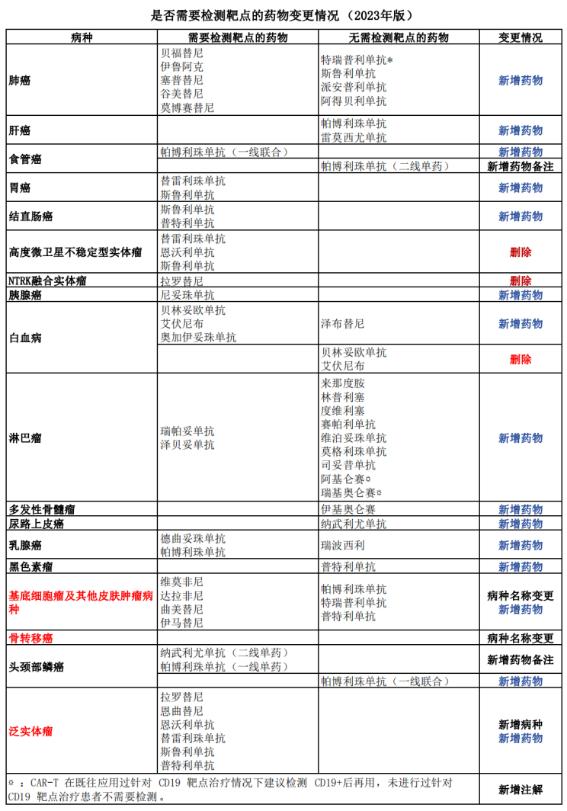
2023年版《指导原则》再次强调,对于明确作用靶点的药物,须遵循靶点检测后方可使用的原则。检测所用的仪器设备、诊断试剂和检测方法应当经过国家药品监督管理部门批准,特别是经过临床试验伴随诊断验证的方法,不得在未做相关检查的情况下盲目用药。根据是否需要检测靶点,将常用的小分子靶向药物和大分子单克隆抗体类药物分为两大类。
对照2022年版,2023年版《指导原则》在是否需要做靶点检测的列表中,除了加入了新增药物,还新增了部分药物备注,如在食道癌用药中“帕博利珠单抗”更新为“帕博利珠单抗(二线单药)”,而在头颈部癌种,则更新为“帕博利珠单抗(一线单药)”……同时,变更了两项病种的名称,由“基底细胞癌”变更为“基底细胞瘤及其他皮肤肿瘤病种”;由“实体瘤骨转移”变更为“骨转移癌”。另外,还将2022年版中的“高度微卫星不稳定型实体瘤”以及“NTRK融合实体瘤”的药物部分删除,一并纳入“泛实体瘤”部分。具体变化详见下表:
“泛实体瘤用药”引关注
尤其值得关注的是,2023年版《指导原则》新增了“泛实体瘤用药”的章节,深化了“异病同治”治疗理念,即针对癌细胞特定的基因组异常或分子特征,而与肿瘤或组织无关的治疗方法,这一理念的转变将极大地拓宽肿瘤治疗的可能性。
在泛实体瘤用药的指导内容中,罗列了目前在中国已获批泛瘤种适应症的6个药物,包括4种PD-1抑制剂(替雷利珠单抗、恩沃利单抗、斯鲁利单抗、普特利单抗),在不可切除或转移性高度微卫星不稳定型(MSI-H)或错配修复基因缺陷型(dMMR)的既往治疗后出现疾病进展且无满意替代治疗方案的成人晚期实体瘤患者中应用,以及2种靶向药物(拉罗替尼、恩曲替尼),其主要针对携带神经营养酪氨酸受体激酶(NTRK)在泛瘤种中的应用。
另外,在BRAF治疗部分,此次更新了美国FDA在2023年新增了的“曲美替尼+达拉非尼”方案适应症的更新,包括在1岁及以上需要全身治疗的BRAFV600E突变的低级别胶质瘤(LGG)儿童患者。

2023年版《指导原则》的更新,不仅汇聚了最前沿的临床研究成果,而且进一步加快了泛癌种疗法临床实践的脚步,创新肿瘤诊疗方式,更是为临床医生在面对复杂多变的肿瘤类型时,提供更有效、更精准的治疗策略。
规范化肿瘤用药道阻且长
随着癌症治疗临床实践的快速发展,目前上市的抗肿瘤药物尚不能完全满足肿瘤患者的用药需求,药品说明书也往往滞后于临床实践,一些具有高级别循证医学证据的用法未能及时在药品说明书中进行修订。然而,在实际的肿瘤临床诊疗中,超说明书、超适应症、超指南等超限用药的情况普遍存在。
2021年,上海一起“肿瘤门”事件,在当时引发业界及社会公众高度讨论,至今仍让人记忆犹新。该事件由张煜医生发文质疑陆巍医生在治疗过程中超适应症乱用药、向患者推荐不必要的基因测序与不合规的细胞免疫治疗,并涉嫌不正当利益交换开始,随即在网上轩然大波。国家卫健委当即介入调查,经专家团评定陆巍的治疗方案基本符合规范;而后上海卫健委对陆巍进行了卫生健康行政处罚。处罚结果为警告、罚款人民币叁万元整,以及暂停执业6个月。
根据相关公示,对于陆巍的处罚事由是未按规定告知患者病情、医疗措施、医疗风险、替代医疗方案等,以及未按规定填写、保管病历资料,或者未按规定补记抢救病历,违反了《医疗纠纷预防和处理条例》中的相关条例。此外,为案件中的患者进行NK细胞免疫治疗的涉事公司,则因未取得医疗机构执业许可证擅自执业,被上海市长宁区卫健委处罚,共计罚没款项165万元。
值得关注的是,政策端始终高度重视抗肿瘤药物的合理使用情况,相关部门不断推动相关政策制度的更新完善,旨在保证临床用药安全、规范用药行为,最大限度维护患者自身权益。
2022年新修订的《中华人民共和国医师法》第29条规定,“医师应当坚持安全有效、经济合理的用药原则,遵循药品临床应用指导原则、临床诊疗指南和药品说明书等合理用药。在尚无有效或者更好治疗手段等特殊情况下,医师取得患者明确知情同意后,可以采用药品说明书中未明确但具有循证医学证据的药品用法实施治疗。医疗机构应当建立管理制度,对医师处方、用药医嘱的适宜性进行审核,严格规范医师用药行为。”这表示肿瘤临床治疗,遵循循证医学证据是根本,而超说明书用药必须在具有循证医学证据的情况下方可使用。
在本次更新的《指导原则》中也强调,“特殊情况下抗肿瘤药物循证医学证据采纳根据依次是:其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、临床诊疗指南,国家级学协会发布的经国家卫生健康委员会认可的诊疗规范、临床诊疗指南和临床路径等。”
同时,国家卫健委于2021年制定的《抗肿瘤药物临床应用管理办法(试行)》也规定,“在尚无更好治疗手段等特殊情况下,医疗机构应当制定相应管理制度、技术规范,对药品说明书中未明确、但具有循证医学证据的药品用法进行严格管理。”
此外,国家医保局也在另一层面,通过丰富肿瘤临床用药选择、强化医保基金监管力度,促进肿瘤药物临床的合理使用。
除了临床使用端,医保支付端对于合理用药的关注也持续趋严。2021年,阿斯利康旗下员工篡改肿瘤患者基因检查结果以骗取医保基金,引发广泛关注。据通报结果,涉案人员已全部依法逮捕。类似抗癌药物涉嫌骗保的案件远不止一起。
对此,就在通报阿斯利康丑闻的同一天,国家医保局发布了《医疗保障基金使用监督管理举报处理暂行办法》,鼓励社会公众和新闻媒体对涉嫌骗保的行为,进行社会监督和舆论监督,切实维护医疗保障基金安全,共同促进临床用药合理化、规范化、有序化。
另外,国家医保局于2022年3月发布《医疗保障基金智能审核和监控知识库、规则库管理办法(试行)》,并于2023年5月向社会公开发布“两库”框架内容。其中,涉及药品使用类的规则总体原则是在维护医保基金安全、防止药品不合理使用的基础上,逐步减少不必要的支付限定,将用药选择权、决策权还给临床医生,方便临床施治、维护用药公平。今后,我们将依据医保目录药品支付范围的调整,同时调整完善智能审核和监控规则,推动定点医药机构合理用药、安全用药,维护基金安全,保障参保人权益。
总的来说,这是医保部门通过智能化监管手段加强医保基金监管,根本目的是规范临床合理用药,保护人民群众“看病钱”“救命钱”,从根本上保障参保人看病就医的权利。一方面,参保人看病就医需经过身份识别,严格执行实名就医购药制度,确保人证相符。另一方面,智能监管系统通过规则的运行来规范定点医药机构的诊疗行为,对医务人员不合理的诊疗、检查、开药行为实时提醒,引导医务人员自觉遵守临床诊疗规范和医保管理政策,依法合规、合理规范开展医药服务,确保医保基金安全高效、合理使用,保护参保人享受规范医疗服务的权益。
编辑:晚晚
