Nature Communications | 柯莎课题组/黄永棋课题组合作揭示小分子调控tau蛋白相分离和聚集的机制
转自:生物谷
细胞内的蛋白质、核酸等大分子通过液-液相分离(liquid-liquidphaseseparation,LLPS),动态组装成高度浓缩且具有类似液体性质的凝聚体微区,执行不同的生物学功能。相分离的异常是多种神经退行性疾病发病机制中的早期诱发事件之一,目前已有研究发现包括TDP-43,FUS,Tau等在内的退行性疾病相关的蛋白,均能够在细胞内和体外发生液-液相分离,并且在特定条件下促进液-固转化,导致病理性聚集物的形成。由于蛋白质相分离与病理性聚集存在密切的关联,靶向调控相分离过程和功能的小分子药物,将有望为神经退行性疾病的预防和治疗提供全新的思路。
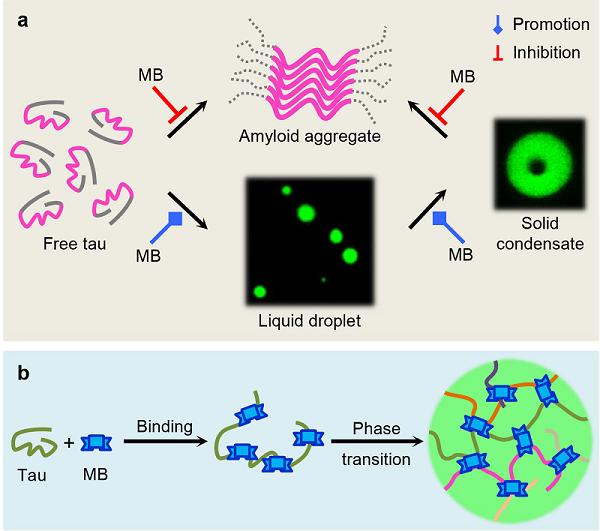
Tau蛋白与阿尔茨海默症等多种神经退行性疾病相关。在正常生理状态下,tau蛋白具有结合微管并调控其组装成束的功能。而在病理条件下,tau蛋白会形成以微管结合区域为核心的淀粉样聚集物,近年研究还发现tau蛋白的相分离可能是导致tau蛋白淀粉样聚集的促发因素。通过小分子药物抑制tau蛋白的淀粉样纤维化、解聚tau蛋白的毒性聚集体是治疗tau蛋白相关疾病的策略之一。以往研究中发现亚甲基蓝(MB)及其衍生物LMTM能够有效抑制tau蛋白的淀粉样聚集,但对于MB及其衍生物是否通过调控tau蛋白相分离发挥其抑制纤维化的活性尚不清楚。鉴于tau蛋白的相分离与其功能态和病理态存在的复杂关联,深入研究MB及其衍生物对相分离态的调控作用、揭示该过程中涉及的分子间互作机制及其对tau蛋白淀粉样聚集的影响具有重要的意义。
生物物理所柯莎课题组与湖北工业大学黄永棋课题组合作,系统地研究了MB通过调控tau蛋白LLPS抑制毒性聚集体生成的机制。首先,研究者发现MB及其衍生物LMTM能够显著促进tau蛋白的相分离,通过FRAP以及光镊等实验揭示MB能够加速相分离态的tau蛋白液滴发生凝胶化。进一步通过NMR、FRET、以及分子对接等研究,揭示MB与tau蛋白的多个结构域发生广泛的相互作用,促使tau蛋白构象伸展,促进tau蛋白形成分子间静电作用和疏水作用网络。与以往所认为的相分离态固化能够加速淀粉样聚集所不同的是,尽管MB促进了tau蛋白的相分离及凝胶化,但却延缓了具有细胞毒性的tau蛋白淀粉样纤维的生成。荧光成像及细胞毒性实验显示,与tau蛋白自身形成的纤维状聚集体相比,MB诱导的tau蛋白相分离态及凝胶态降低了细胞毒性,同时对tau蛋白促进微管组装的功能并无显著影响。此外,以往的研究认为MB及其衍生物与tau蛋白内在半胱氨酸的互作及氧化作用,对其发挥抑制聚集的活性至关重要,然而本研究发现MB通过调控tau蛋白相分离态而抑制毒性聚集体生成的过程并不依赖于MB对tau蛋白的半胱氨酸的氧化作用。上述研究结果表明,尽管MB分子通过与tau蛋白不同结构域的广泛互作,加速了tau蛋白分子间相互作用网络的形成,但这种分子间相互作用却不利于具有细胞毒性的淀粉样聚集体形成,从而揭示了MB通过调控tau蛋白相分离过程实现抑制其淀粉样聚集的全新分子机制。
上述研究成果于2023年9月6日在线发表在NatureCommunications杂志,标题为Methyleneblueacceleratesliquid-to-geltransitionoftaucondensatesimpactingtaufunctionandpathology。中国科学院生物物理所柯莎课题组项目研究员吴思和湖北工业大学黄永棋副教授、高萌博士为本文的共同通讯作者,黄永棋副教授与柯莎组博士后温纪涛为本文的第一作者,柯莎研究员对本工作的开展给予了重要指导,德国马克斯·普朗克研究所MarkusZweckstetter教授课题组、美国肯特国立大学HanbinMao教授课题组、以及匹兹堡大学JunmeiWang教授课题组在核磁共振、光镊和分子对接等方面也为本研究工作做出了重要贡献。该研究得到了科技部、国家自然科学基金委项目等的资助。
文章链接:https://www.nature.com/articles/s41467-023-41241-6
