【First-in-class药设系列】核糖体eRF1的分子胶设计与功能发现
转自:药时代
在真核生物中,当终止密码子(即UAA,UAG,UGA)进入核糖体的A位点时,真核释放因子eRF1(eukaryoticreleasefactor1)和eRF3介导的翻译终止被触发。其中,eRF1参与到了翻译终止的所有步骤,它负责识别终止密码子、诱导新生多肽的释放、促进核糖体的再循环;而eRF3是一种促进新生多肽释放的鸟苷三磷酸酶(GTPase)。
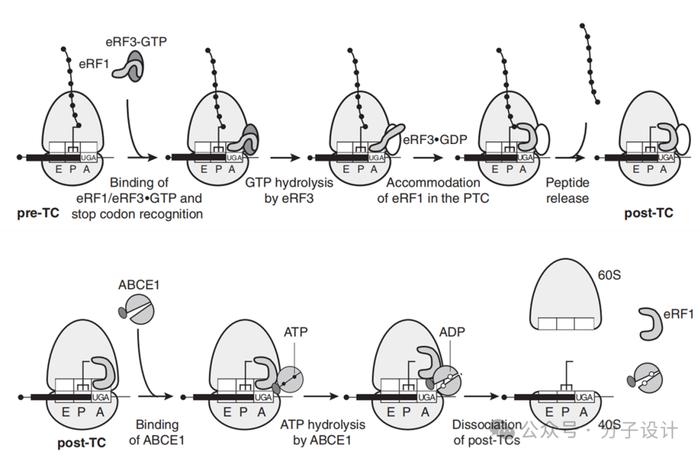
通常,eRF1/eRF3·GTP结合至终止前复合物(pre-TC,thepreterminationcomplex)的A位点,此时结合有GTP的eRF3致使eRF1处于非活性构象,阻止eRF1的M结构域接触核糖体的肽基转移酶中心(PTC,peptidyl-transferasecenter)。随后,GTP被eRF3水解,eRF1的M结构域的eRF1的GGQ基序定位在PTC,使新生多肽被释放,形成了终止后复合体(post-TC,post-terminationcomplex)。最后,ATP结合盒E1(ABCE1,ATP-bindingcassetteE1)与post-TC上的eRF1结合,完成了核糖体的再循环,为新一轮的翻译做准备。
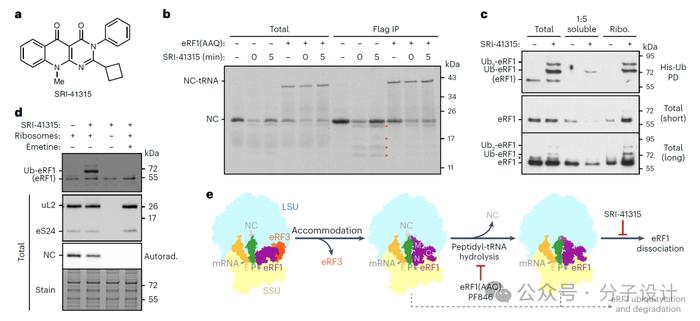
鉴于eRF1在翻译终止全过程中均扮演着重要角色,研究人员一直在寻找触发eRF1降解,增强过早终止密码子翻译通读的小分子,通过高通量筛选,首次发现了eRF1的降解剂SRI-41315。它能够通过降低eRF1的丰度来抑制PTCs,同时也能增强氨基糖苷介导的通读能力,协同增强囊性纤维化跨膜电导调节因子(CFTR,cysticfibrosistransmembraneconductanceregulator)突变体的表达和功能。
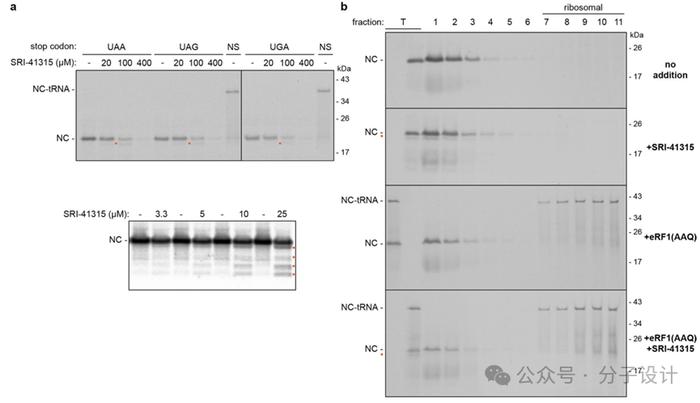
在无细胞哺乳动物翻译系统中,他们发现SRI-41315以剂量依赖性方式抑制放射性标记肽链(3xFlag-tagged nascentchain)的合成。同时,SRI-41315的加入会产生比全长模型蛋白小的放射性标记产物。在SRI-41315作用下,合成的新生多肽不会附着在tRNA上,而是从核糖体中释放出来。相反地,在不包含终止密码子或加入过量的eRF1AAQ突变体(eRF1GGQ基序突变为AAQ,其能够抑制新生多肽的释放)的情况下,会观察到NC-tRNA加合物的出现。这说明SRI-41315抑制NC的翻译,但不抑制其释放。
随后,他们检测了SRI-41315如何影响无细胞翻译系统中的eRF1,重点关注eRF1泛素化和与核糖体的结合。实验结果表明,SRI-41315以剂量依赖性方式特异性诱导eRF1泛素化。SRI-41315依赖性eRF1泛素化过程约是无细胞系统合成新生多肽所需的时间的4倍,这种动力学差异表明RNF14介导的降解途径选择性靶向异常保留在核糖体上的翻译因子;从翻译提取物中移除核糖体或加入高浓度的翻译延长抑制剂Emetine可消除eRF1泛素化,这表明活跃的翻译是必须的。在SRI-41315存在的情况下,未经修饰和泛素化的eRF1都优先保留在核糖体上。SRI-41315对eRF1的稳定会产生停滞的翻译终止复合物,导致未解离的eRF1被泛素化,最终被降解。
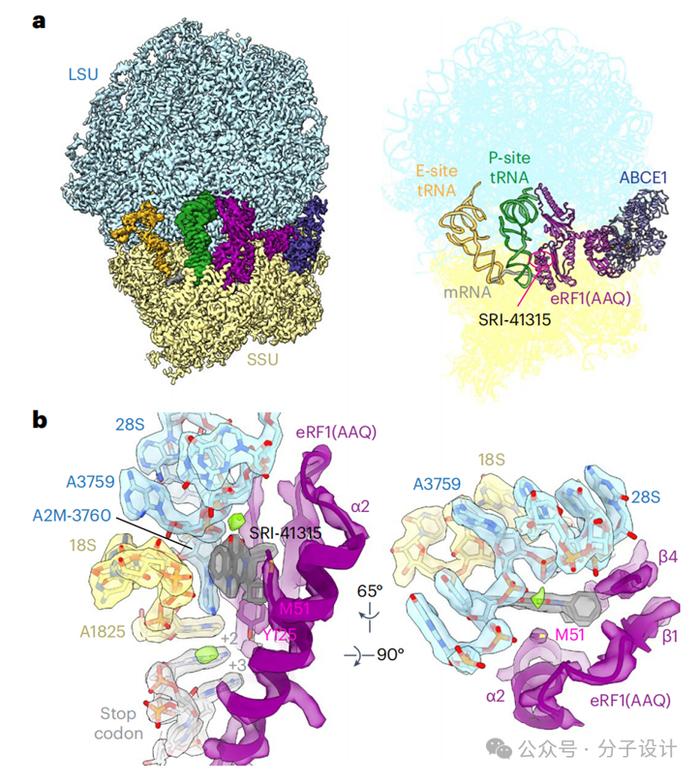
随后,研究人员解析了SRI-41315在终止核糖体上的Cryo-EM结构。结构表明,SRI-41315结合在核糖体解码中心附近,位于由eRF1的α2、β1和β4亚基、18SrRNA的U1827和C1828的磷酸骨架以及28SrRNA的A3759和3760位的2′-O-甲基腺苷(A2M-3760)形成的口袋中,创建了一个金属依赖性相互作用网络,将eRF1N结构域锚定到核糖体亚基界面——首先,镁离子紧密配位SRI-41315的双羰基、A2M-3760骨架的非桥接氧和28SrRNA的A3759以及可见的水分子;其次,SRI-41315夹在eRF1α2上的Met51和28SrRNA的A2M-3760之间;第三,SRI-41315的环丁基与eRF1的β4上的Tyr125有堆积作用。
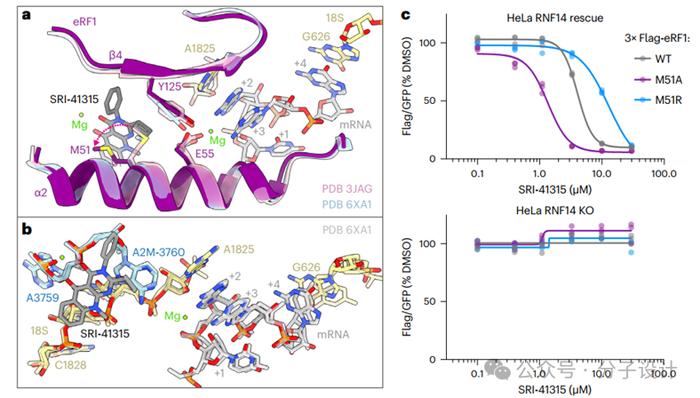
SRI-41315的存在对eRF1构象的改变并不大,其中最显著的变化是eRF1的Met51的位置,它通常会与SRI-41315的环丁基发生冲突,必须摆动约4.5Å以适应SRI-41315的结合。在与SRI-41315接触的两个eRF1残基中,Tyr125对终止密码子识别至关重要,而Met51具有诱变的可行性。由于Met51与SRI-41315的嘧啶酮之间的构象变化和疏水相互作用,作者推测Met51突变可能会影响SRI-41315诱导的eRF1降解的效力。实验表明,将51位Met突变为Ala,SRI-41315效力增加约三倍;若突变为Arg,则会削弱SRI-41315效力。与WTeRF1类似,在RNF14敲除细胞中,SRI-41315诱导的Met51突变体的降解被消除。诱变结果与结构模型一致,表明Met51在SRI-41315结合中起重要作用。Met51突变为Ala可消除环丁基部分带来的位阻;而该位置突变为Arg效果不佳,可能是因为它靠近Arg47并且不利于镁离子与SRI-41315结合。
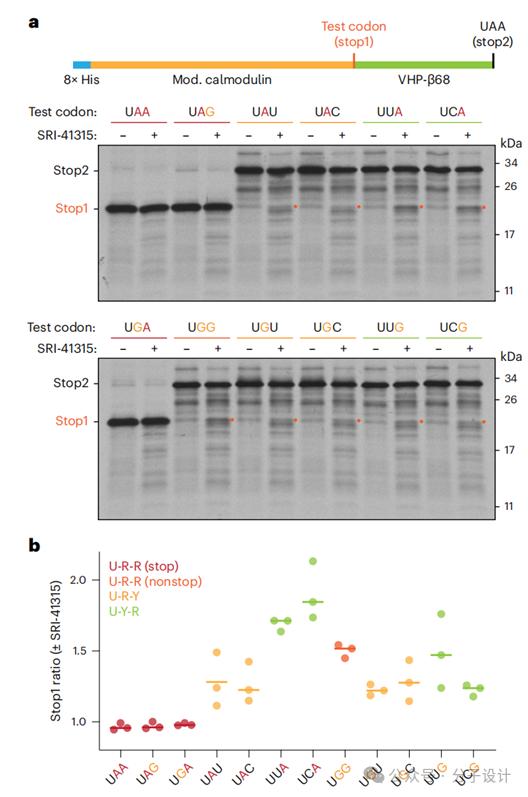
此外,他们假设SRI-41315增加了近同源终止密码子的翻译终止频率,设计了一个报告基因结构,系统地分析在特定位置上使用不同密码子的翻译终止。研究表明,SRI-41315可诱导近同源终止密码子(crypticstopcodons)的翻译终止。
综上,研究人员发现SRI-41315在负责终止密码子识别的eRF1N结构域和解码中心附近的核糖体亚基界面之间充当金属依赖的分子胶,导致核糖体碰撞、eRF1泛素化、翻译终止的频率增高,揭示了一种新的释放因子抑制机制。
参考文献
1.CoelhoJPL,YipMCJ,OltionK,TauntonJ,ShaoS.TheeRF1degraderSRI-41315actsasamolecularglueattheribosomaldecodingcenter.NatChemBiol.2024.doi:10.1038/s41589-023-01521-0
2.HellenCUT.TranslationTerminationandRibosomeRecyclinginEukaryotes.ColdSpringHarbPerspectBiol.2018;10(10):a032656.doi:10.1101/cshperspect.a032656
3.MichaelR.Lawsonetal.Mechanismsthatensurespeedandfidelityineukaryotictranslationtermination.Science.2021;373:876-88.doi:10.1126/science.abi7801
4.BrownA,ShaoS,MurrayJ,HegdeRS,RamakrishnanV.Structuralbasisforstopcodonrecognitionineukaryotes.Nature.2015;524(7566):493-496.doi:10.1038/nature14896
封面图来源:123rf

