11月6个1类中药新药申报,7个首仿品种获批,6个存量品种首家过评
来源:米内网
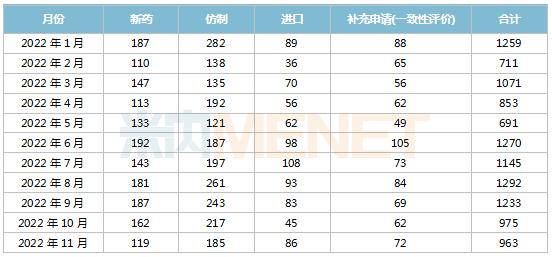
据米内网中国申报进度(MED)数据库统计,2022年11月CDE共承办药品注册申请963件。
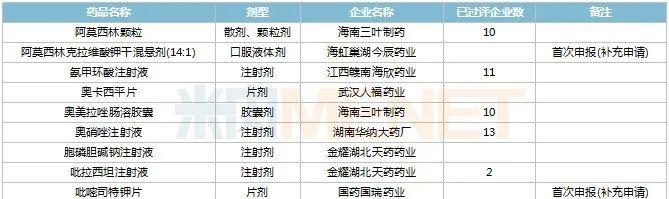
2022年11月,48个品种的一致性评价补充申请获CDE承办。阿莫西林克拉维酸钾干混悬剂(14:1)、吡嘧司特钾片、复方电解质注射液(Ⅱ)、米格列奈钙片、瑞巴派特片、替米沙坦氢氯噻嗪片、盐酸甲氧氯普胺注射液等7个品种为首次申报。
11月CDE补充申请(一致性评价)品种承办情况
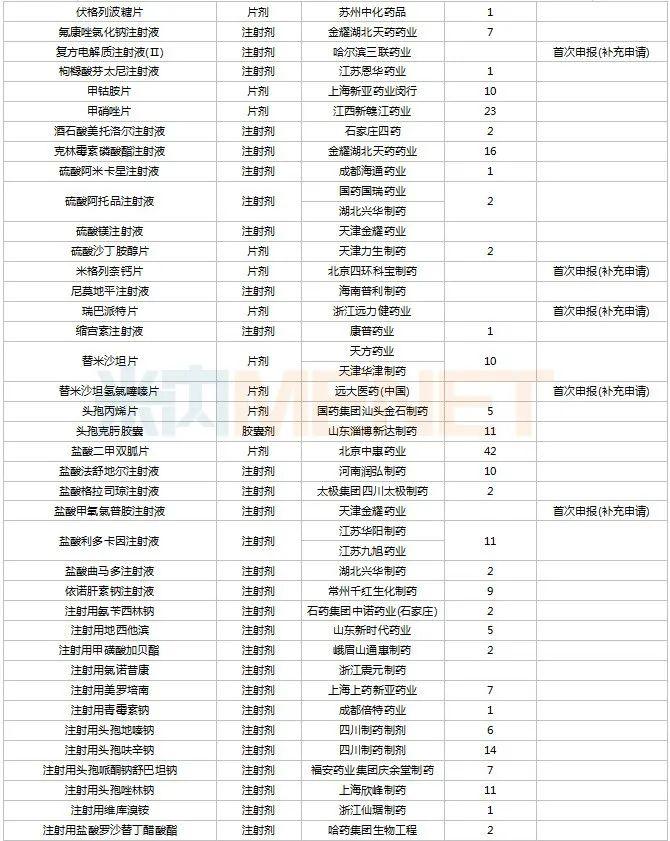
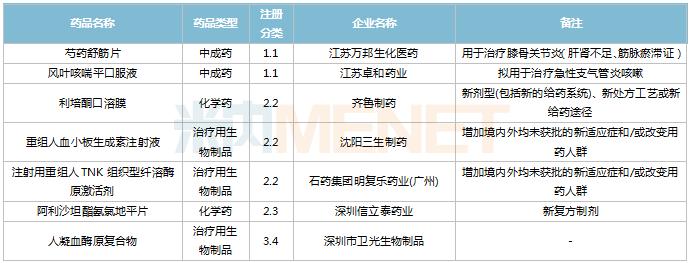
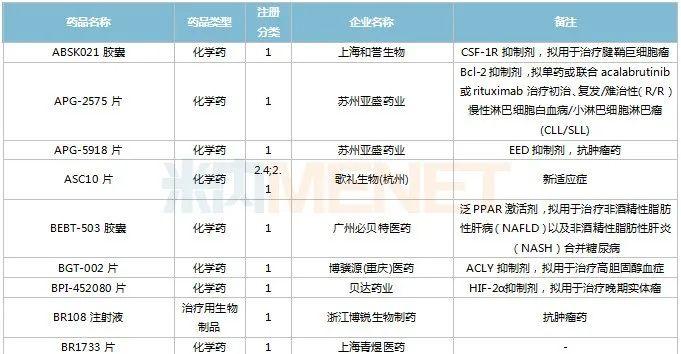
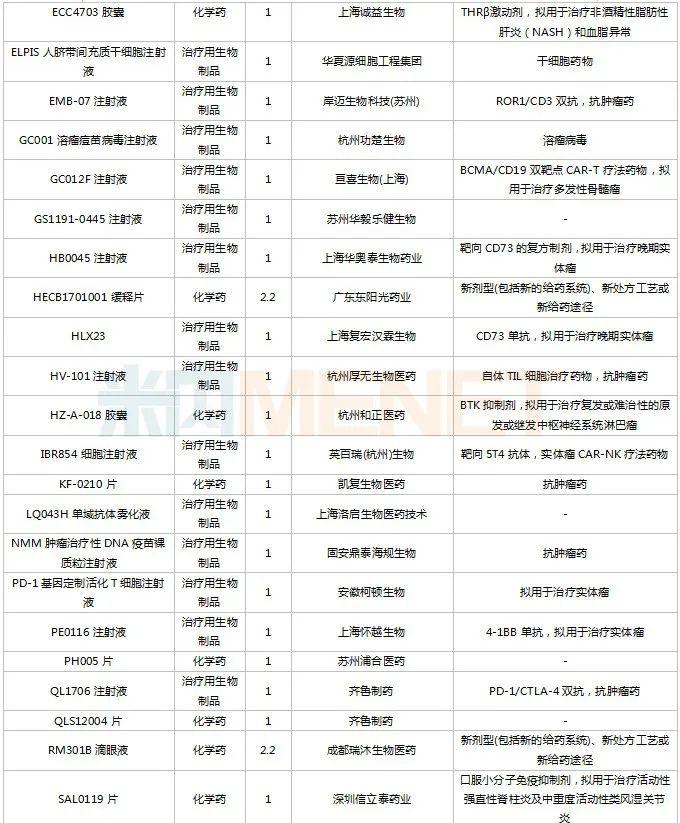
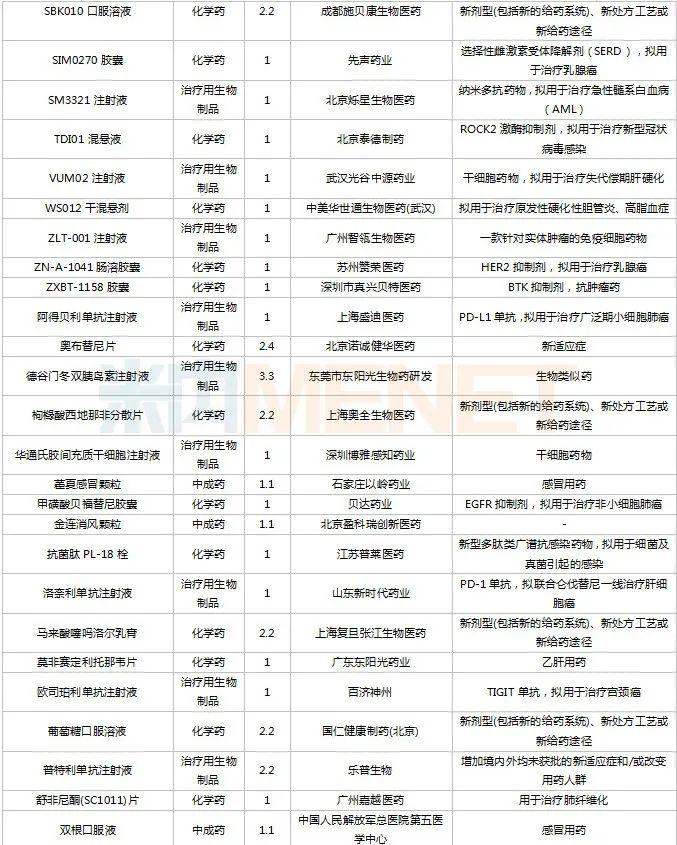
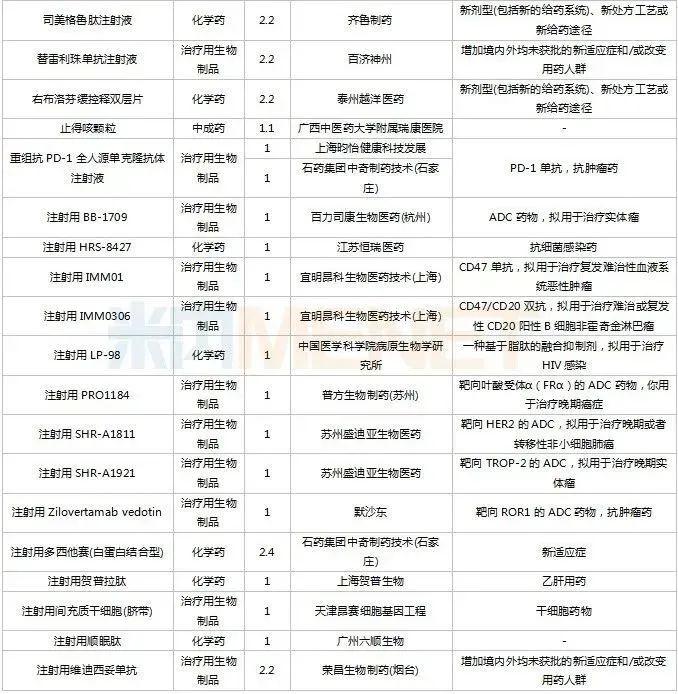
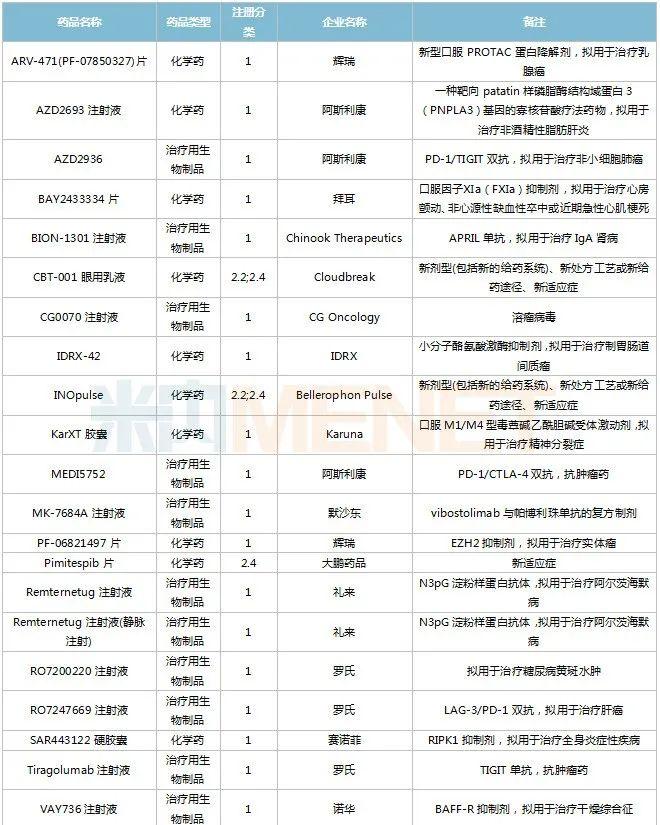
2022年11月,83个品种的新药申请获CDE承办。1类新药有63个,其中中成药有6个,2类改良型新药有19个,生物类似药1个。江苏万邦生化医药的1.1类中成药芍药舒筋片以及江苏卓和药业的1.1类中成药风叶咳喘平口服液申报上市。沈阳三生制药的重组人血小板生成素注射液以及石药集团明复乐药业(广州)的注射用重组人TNK组织型纤溶酶原激活剂为新适应症上市申请。
11月国内新药临床申请承办情况
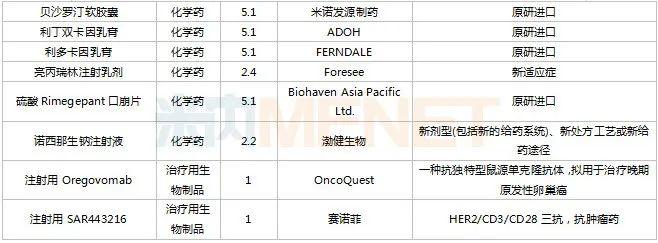
2022年11月,130个品种的仿制申请获CDE承办,其中6-[18F]氟-L-多巴注射液、奥卡西平口服混悬液、丙酸氟替卡松雾化吸入用混悬液、布洛氢可酮片、醋酸维持液(含葡萄糖)、多种微量元素注射液(Ⅲ)、非诺贝特片(Ⅲ)、富马酸非索罗定缓释片、枸橼酸坦度螺酮片、枸橼酸西地那非干混悬剂、骨化三醇注射液……等27个品种目前暂无国产仿制药获批。
11月国内仿制申请承办情况
2022年11月,43个品种的进口申请获CDE承办。其中1类新药有21个,2类改良型新药有5个,5.1类进口原研药有10个,5.2类进口仿制药有5个。
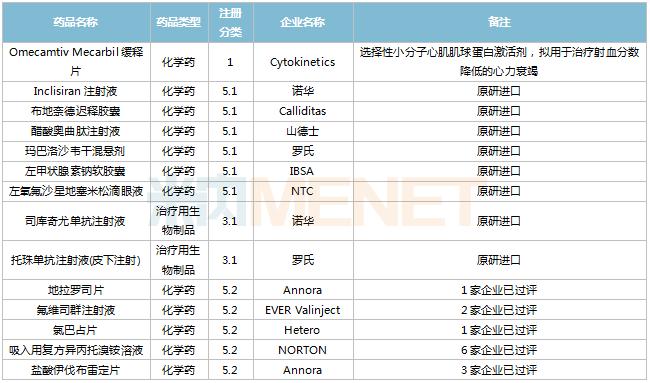
11月进口临床申请承办情况
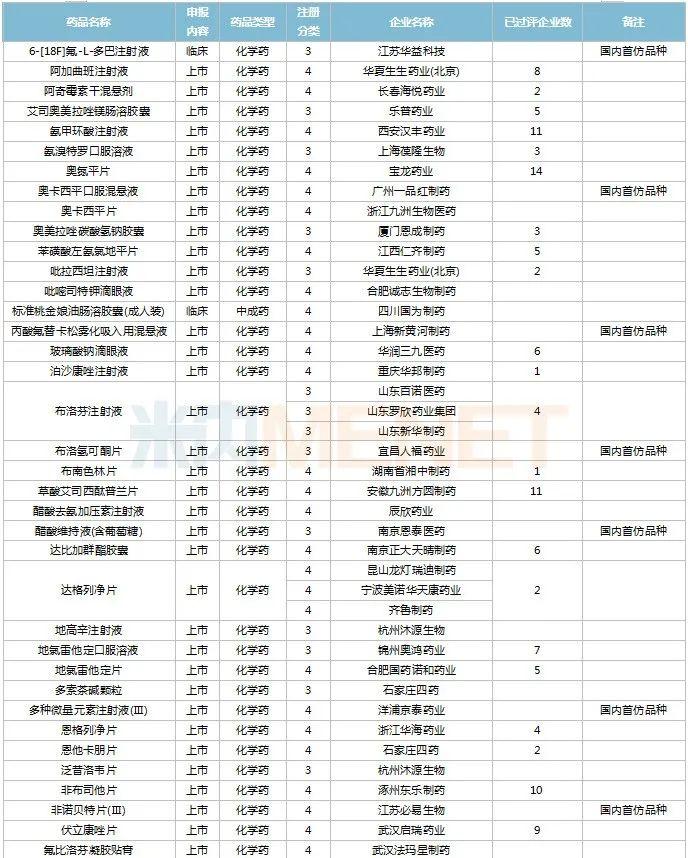
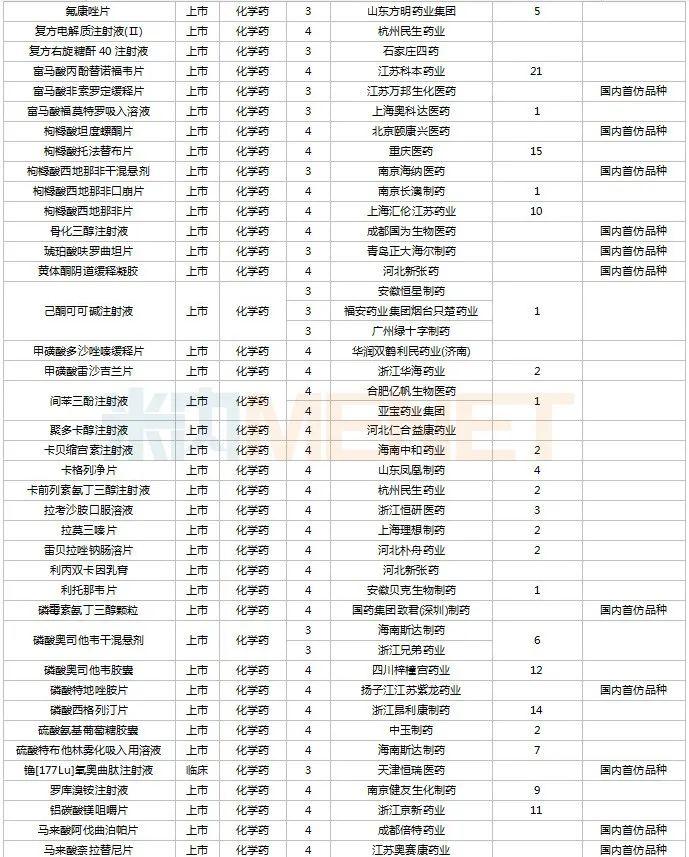
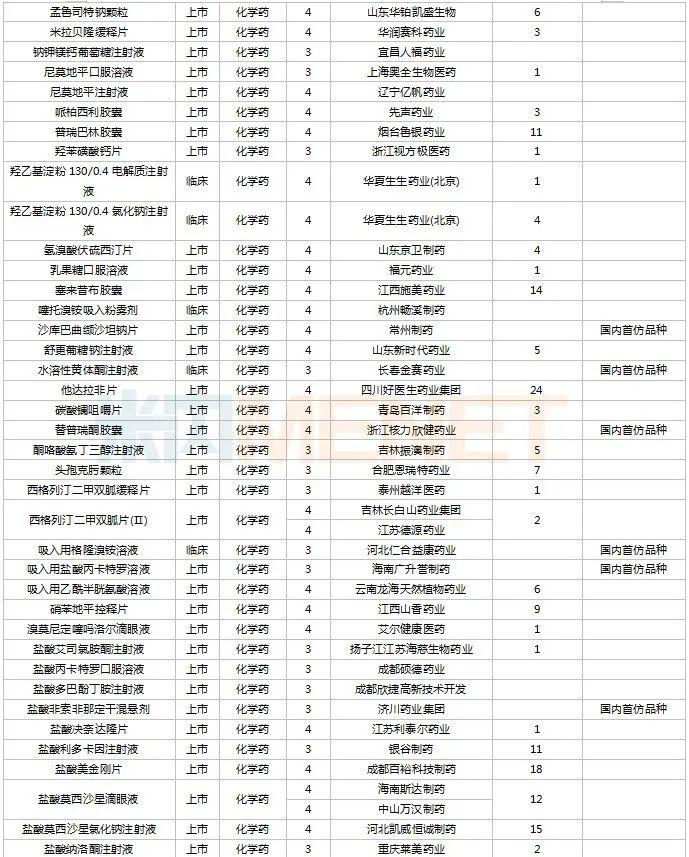
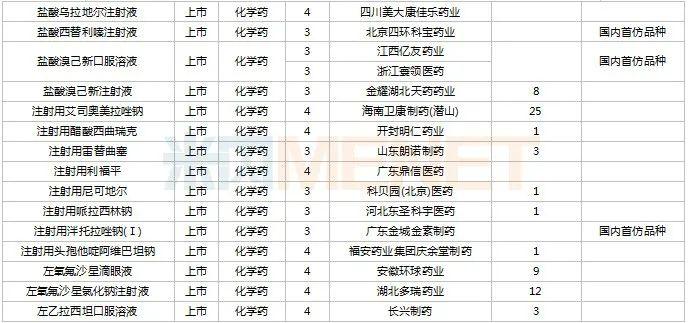
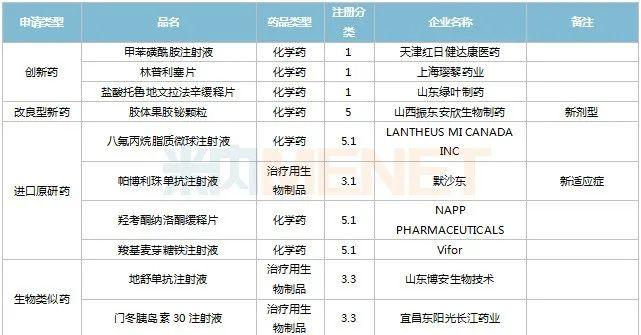
2022年11月,天津红日健达康医药、上海璎黎药业、山东绿叶制药等均有1类新药获批上市。山西振东安欣生物制药的胶体果胶铋颗粒为新剂型获批。默沙东的帕博利珠单抗注射液再获批新适应症。81个仿制药获批上市(含进口5.2类),吡美莫司乳膏(江苏知原药业)、氮䓬斯汀氟替卡松鼻喷雾剂(长风药业)、多种油脂肪乳注射液(C6-24)(费森尤斯卡比华瑞制药)、酒石酸艾格司他胶囊(北京凯莱天成医药)、氯吡格雷阿司匹林片(乐普药业)、氯化钾口服溶液(杭州和泽坤元药业)、山梨醇甘露醇冲洗剂(济民健康管理)为国内首仿品种。26个存量品种有企业过评,复方α-酮酸片、富马酸卢帕他定片、泮托拉唑钠肠溶胶囊、盐酸决奈达隆片、盐酸替罗非班注射用浓溶液、注射用哌拉西林钠等6个存量品种首次有企业过评。
11月上市申请品种及一致性评价品种获批情况
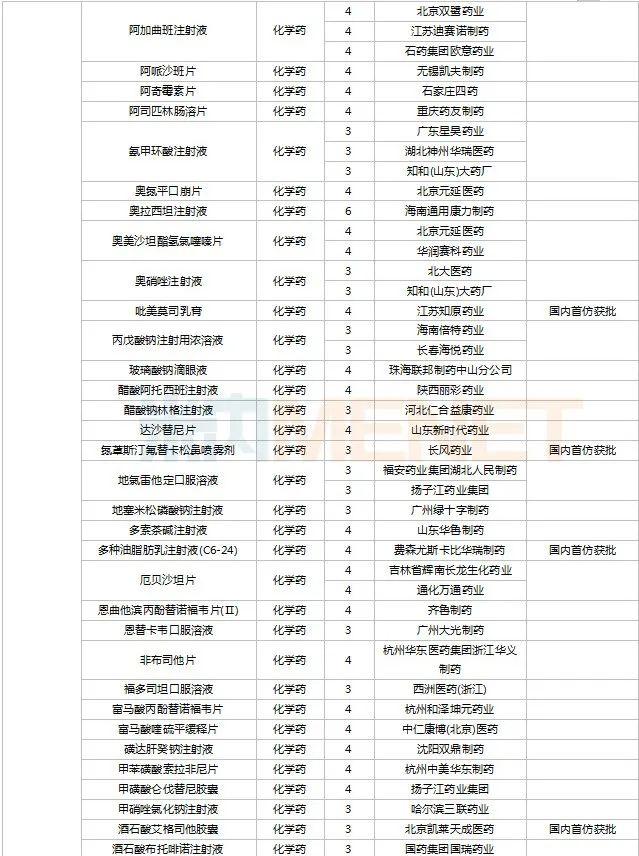
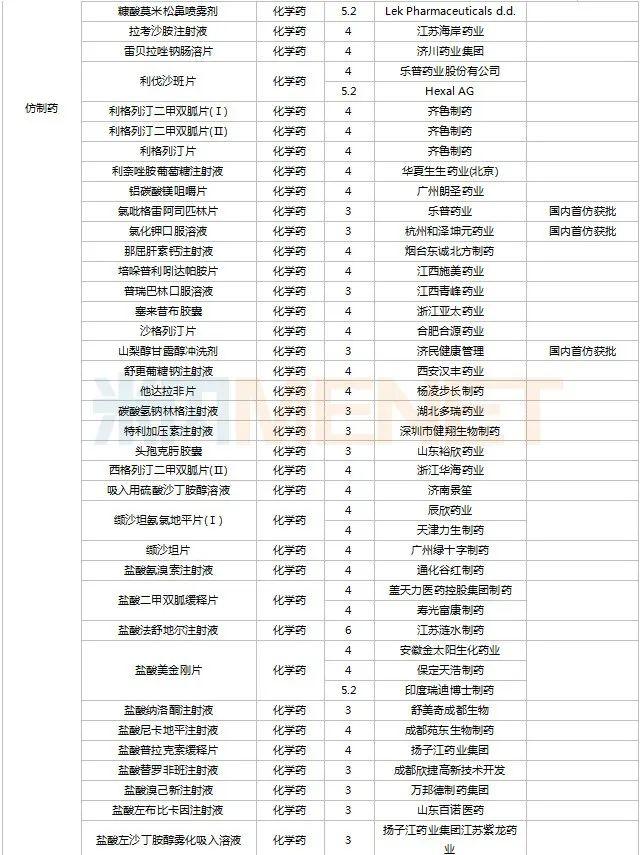
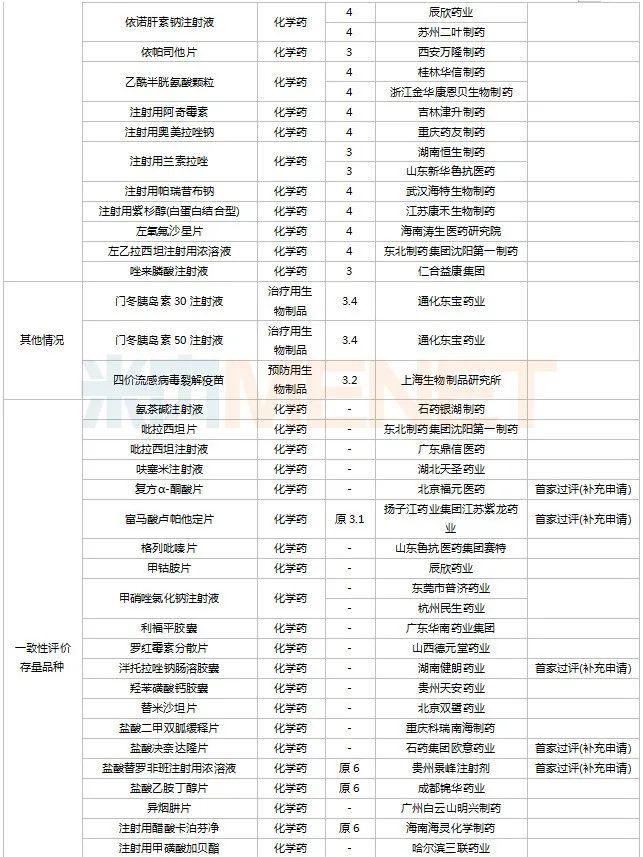
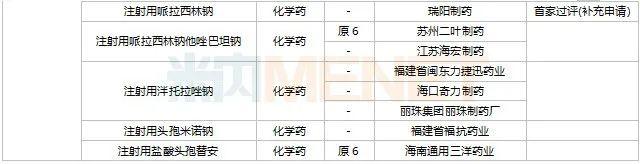
数据来源:米内网MED2.0药品审评数据库、CDE、NMPA;相关统计字段按药品名称统计,时间截至2022年11月30日;药物作用靶点以及适应症整理自公开资料。
