我国43项间充质干细胞新药IND获批!北京有6家企业的9项产品获批,位居全国第二!
转自:药时空
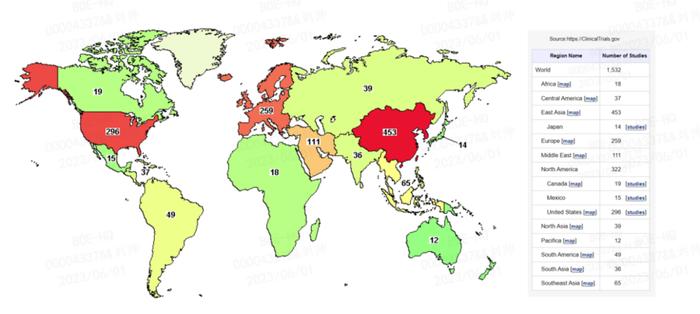
2018年6月8日,国家药品监督管理局(NMPA)药品审评中心(CDE)重新受理干细胞新药临床试验(IND)注册申请,干细胞药物临床试验的申请稳步增长,新药研发速度明显加快。特别是间充质干细胞(MSC),作为再生医学中重要的成体干细胞,具有再生特性,如自我更新、分泌营养因子和诱导间充质细胞谱系的能力,同时还可以调节免疫系统,增强组织修复,因此,在细胞疗法中具有广阔的应用前景。截至目前,已有1532项基于间充质干细胞的临床试验在ClinicalTrials.gov数据库中登记为已完成或正在进行中。
-01-
我国间充质干细胞药物临床试验默示许可情况
截至2023年5月31日,我国共有29家企业的43项间充质干细胞药物临床试验获得国家药监局药审中心默示许可。其中,2022年新增默示许可18项,较2021年度增长了一倍,2023年有望再创新高。
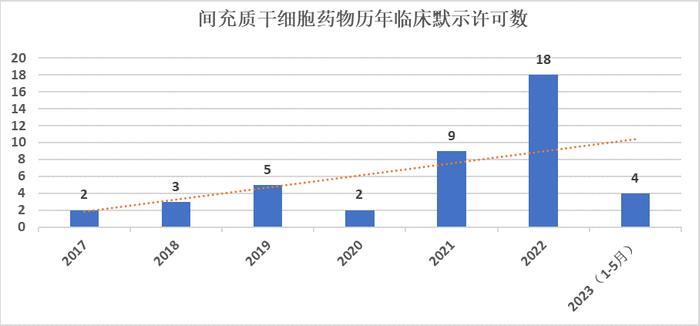
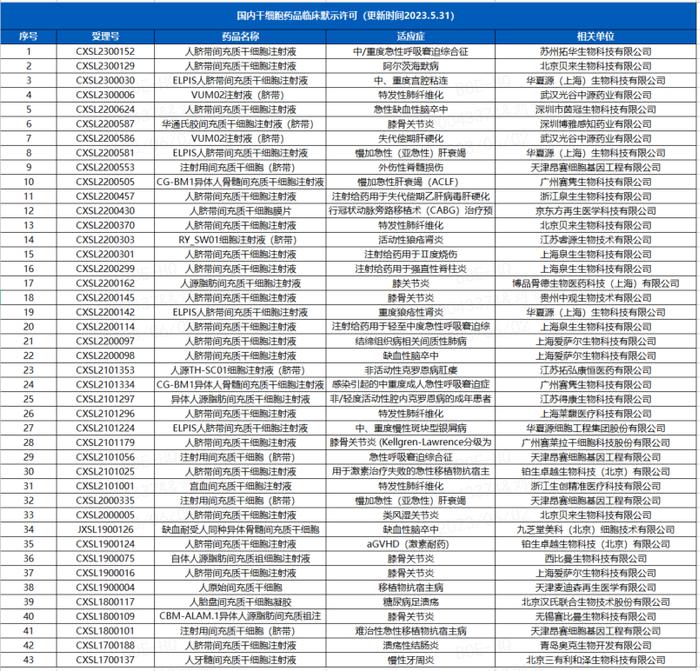
表1国内间充质干细胞药物临床试验默示许可
-02-
临床适应症分析
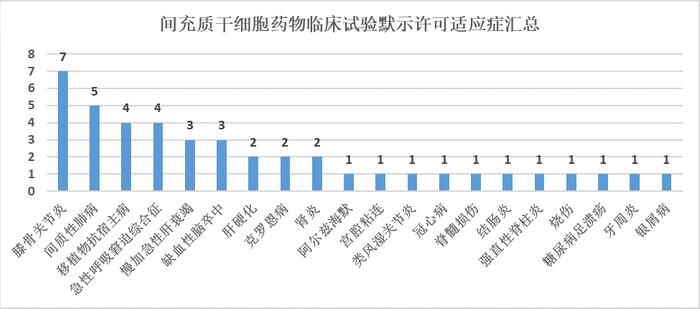
我国43项间充质干细胞临床试验涉及21项适应症,其中位于前六的适应症分别是:膝骨关节炎(7项)、间质性肺病(5项)、移植物抗宿主病(4项)、急性呼吸窘迫综合征(4项)、慢加急性肝衰竭(3项)、缺血性脑卒中(3项)。从适应症来看,绝大多数药物利用间充质干细胞的旁分泌和免疫调控功能,以针对缺血性损伤、炎症相关或自身免疫相关疾病展开治疗。
-03-
申报地区情况分析
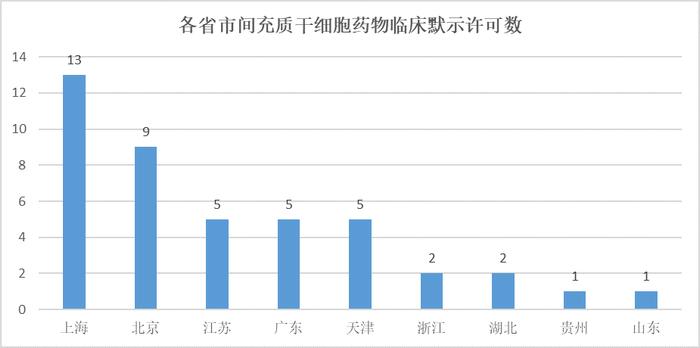
在各省市的间充质干细胞药品申报方面,上海以13项(7家企业)居第一,其次北京以9项(6家企业)居第二,随后依次为江苏、天津、广东。可以看出上海、北京是干细胞药物研发最活跃的地区,长三角地区、京津和广东是中国干细胞药物研发的主力地区。
-04-
申报剂型分析
间充质干细胞药品剂型申报方面,CDE批准的43项间充质干细胞药物临床申请,其中,悬液剂型(含单细胞+凝胶)42项,膜片剂型1项。特别需要指出的,由京东方再生医学科技有限公司研制的“人脐带间充质干细胞膜片”获得临床试验许可,标志着我国干细胞治疗的剂型走向多元化,该剂型药物能够贴敷在病灶部位,可以实现局部定点给药。这一技术解决了现有的细胞制剂难以迁移到病灶部位及无法长期留存发挥疗效的问题,预期可为需局部给药的疾病治疗及组织器官修复带来新希望。
-05-
申报间充质干细胞来源分析
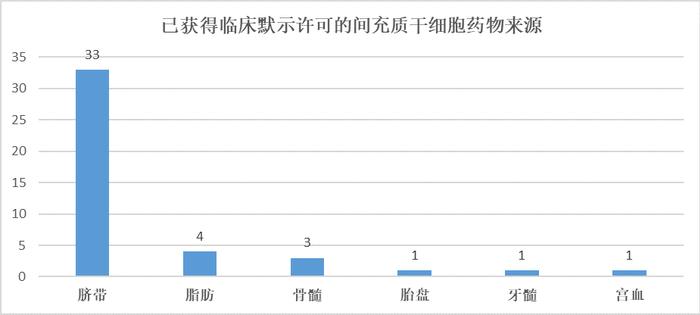
截至2023年5月31日,从获批临床的间充质干细胞类型来看,人脐带间充质干细胞药物合计33项,占比76.7%,是中国干细胞药物研发最主要细胞类型。其次是脂肪来源的间充质干细胞药物4项、骨髓来源间充质干细胞药物3项。其余胎盘来源间充质干细胞药物、牙髓来源间充质干细胞药物、宫血来源间充质干细胞药物各1项。
-06-
未来或迎来高速发展期
全球细胞治疗领域在基础研究方面已取得诸多重大原创性成果,我国干细胞基础研究位居世界前列,为诸多疑难杂症治疗提供了新希望和诊疗方式。随着《干细胞临床研究管理办法(试行)》、《干细胞制剂质量控制及临床前研究指导原则(试行)》、《细胞治疗产品研究与评价技术指导原则(试行)》、《人源干细胞产品药学研究与评价技术指导原则(试行)》等政策出台,我国干细胞临床转化也逐步走向正轨,并逐渐明确了以干细胞药物作为转化出口的道路,干细胞药物申报的数量和质量都有显著增长。预计未来5年将会迎来干细胞药物研发的爆发期,会有更多针对新适应证的干细胞药物进入临床试验阶段,同时,正在开展的干细胞药物临床试验也将逐步取得成果,干细胞作为治疗药物上市将指日可待。
当然,近几年我国干细胞药物取得的发展是离不开干细胞新药研发企业坚定的信念和资源投入,离不开企业研究人员们夜以继日的为干细胞技术的发展默默付出,我们相信他们的成果也必将为人类健康事业带来更多的希望和福祉!
