推荐阅读 | 新药注册时限调研:发补和上市时限会是多少?
转自:注册圈
分享RDPAC在今年5月做的一篇报告,是关于新药注册时限的案例统计,值得注册人关注,尤其是新药研发企业。
本报告的时限均采用常规的工作日进行计算(未根据当年的节假日进行调整)。本报告的时限显示的值默认为中位值。
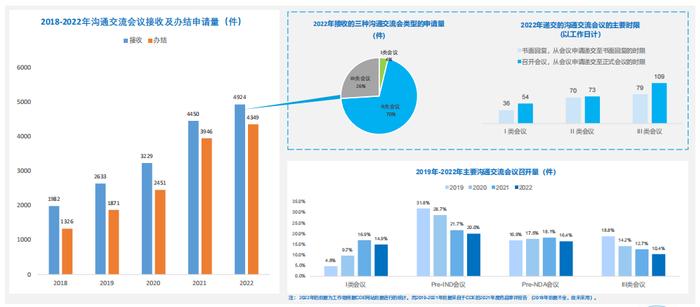
1.全行业近5年CDE接收及办结沟通交流申请:2022年数量创历史新高,II类沟通交流会议申请占比为70%左右:
-2022年接收和办结的申请量均达到近5年的最高峰值,相比于2021年分别增长了10.7%和10.2% ;
-II类沟通交流会议申请数量占比最大。3种沟通交流申请获得最终书面回复的时限中位值均长于法定时限。
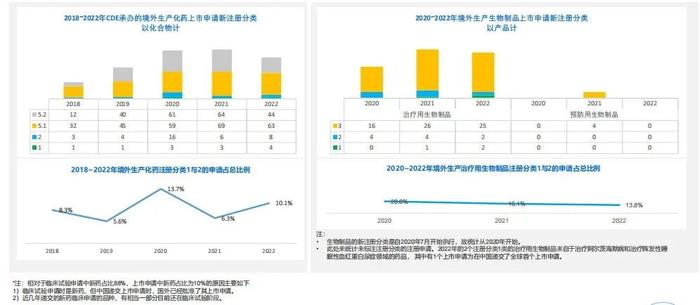
2.全行业近5年CDE承办的境外生产药品上市申请分析:新药上市申请的总体数量在增长,1类创新药上市申请数量越来越多:
-2022年CDE承办的境外生产化药上市申请中,新药(注册分类1与2)占比为10.1%;
-2022年CDE承办的境外生产治疗用生物制品上市申请中,新药(注册分类1与2)占比13.8%,且有在中国递交全球首个上市申请的案例;
-目前还没出现在中国递交境外生产预防用生物制品的新药(注册分类1与2)上市申请。
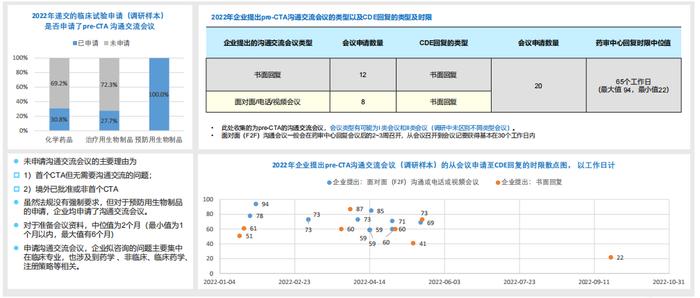
3.RDPAC样本中2022年递交的pre-CTA沟通交流会议分析:CDE书面回复的比例较高,回复时限长于法定时限:
-RDPAC样本显示,从企业提交沟通交流会议申请至药审中心书面回复的时限的中位值为65个工作日;
-从散点图可以看出有约55%的会议申请的药审中心回复时限超过法规规定的60个工作日;
-2022年收到的样本量CDE均以书面形式进行回复。
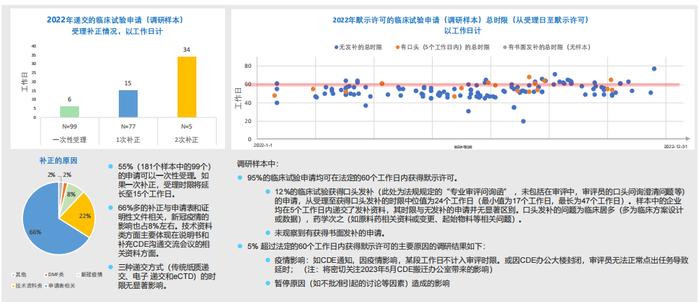
4.RDPAC样本中2022年临床试验申请的关键时限分析:95%申请可在法定时限内获得默示许可,新冠疫情对时限造成一定影响:
-RDPAC样本显示,受理时补正对受理带来了明显延迟(1次补正延迟受理时间约10个工作日);
-95%左右的临床试验申请可在法定时限内获得默示许可,未观察到发补对默示许可总时限产生显著影响。
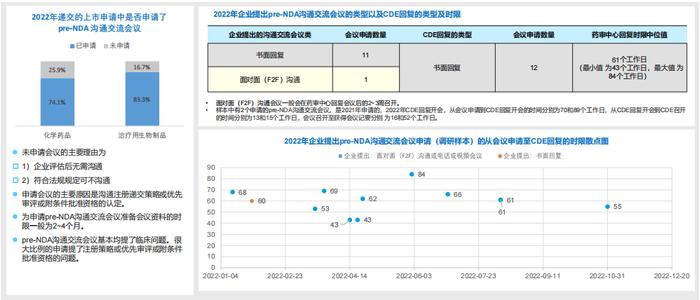
5.RDPAC样本中2022年递交的pre-NDA沟通交流会议分析:CDE书面回复的比例较高,回复时限差异性较大:
-RDPAC样本显示,超过70%的上市申请递交了pre-NDA沟通交流会议申请,从散点图可以看出有约58%的会议申请的药审中心回复时限超过60个工作日;
-回复时限超时的原因1)疫情的影响;2)各专业回复时间不一致(由于样本量小,未分析哪些专业回复时限更长);3)同时观察到不同专业部门回复的时限有差异。
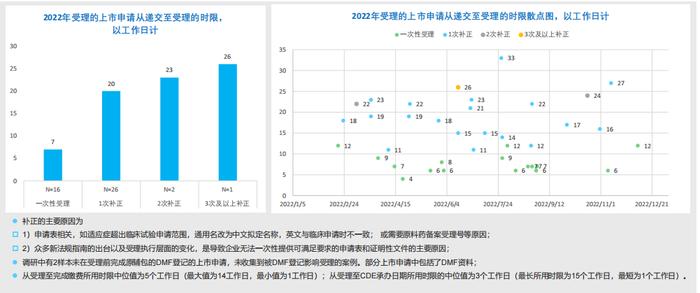
6.RDPAC样本中2022年受理的上市申请的受理补正分析:64% 申请被补正,补正主要原因为申请表与证明性文件:
-RDPAC样本显示,有64%的上市申请受理被补正,其中大部分(58%)为1次补正;
-一次补正从递交至受理的时限中位值为20个工作日。补正的主要原因为申请表和证明性文件。
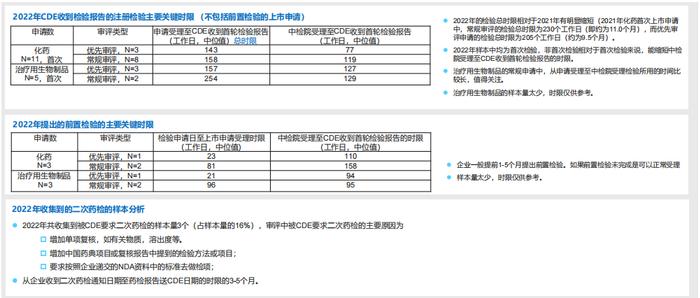
7.RDPAC样本中2022年上市申请注册检验分析:检验所用时限较2021年有所缩短,二次药检的比例为16%:
-样本中化药常规审评品种和优先审评品种的检验总时限分别为158个工作日(即约为8个月)和143个工作日(约为7个月);
-样本中治疗用生物制品常规审评品种和优先审评品种的检验总时限分别为254个工作日(即约为12个月)和157个工作日(即约为8个月);
-企业应注意如何避免审评中被CDE要求二次药检(需要额外3-5个月)。前置检验可减少检测延迟对上市申请的整体审评时限的影响。
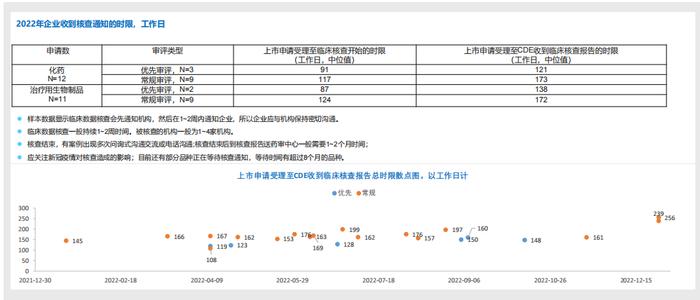
8.RDPAC样本中2022年上市申请临床试验数据核查分析:所用时限较2021年有所缩短,优先审评较常规审评加速2个月左右时间:
-样本中从上市申请受理至临床核查开始的时限:化学的优先审评和常规审评分别为91工作日和117个工作日,治疗用生物制品的优先审评和常规审评分别为87工作日和
124个工作日。
-同时从上市申请受理至CDE收到临床核查报告的时限:化学的优先审评和常规审评分别为121工作日和173个工作日,治疗用生物制品的优先审评和常规审评分别为138工作日和172个工作日。
9.RDPAC样本中2022年上市申请的发补情况分析:上市申请发补较高,且明显影响总时限:
-样本显示,上市申请的首轮发补日期,优先审评品种为受理后的5-6个月(即化药和治疗用生物制品分别为110个工作日和138个工作日),常规审评品种为受理后的7-8个月(即化药和治疗用生物制品分别为183个工作日和159个工作日);
-发补对总时限的影响显著,未收集到二次正式书面发补。
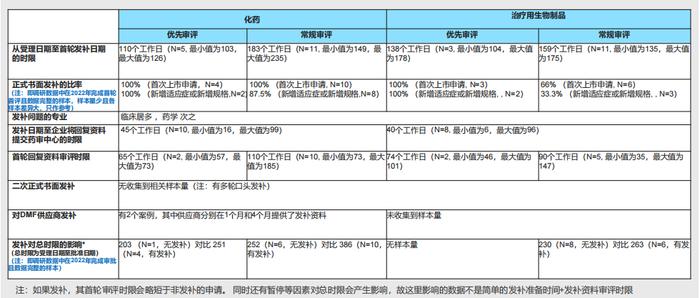
10.RDPAC样本中2022年获批的上市申请的总时限分析:总体相对于2021无显著变化,优先审评对时限的加速比较明显:
-首次上市申请总时限中位值:化药和治疗用生物制品优先审评中位值为13个月,常规审评中化药和治疗用生物制品分别为19个月和17个月;
-新增适应症申请总时限中位值:优先审评中化药和治疗用生物制品分别为10个月和11个月,常规审评中化药和治疗用生物制品分别为13个月和10个月;
-考虑到调研样本量不大,故制定时限时应关注时限散点图中的各样本量时限分布区域,同时关注检验、临床核查和审评暂停等因素的影响。
11.基准时限的计算起始点
临床试验申请时限:从CDE受理日期至默示许可公示日期:
上市申请时限:从正式受理日期至注册证书签字日期。
基准时限的推荐考虑点
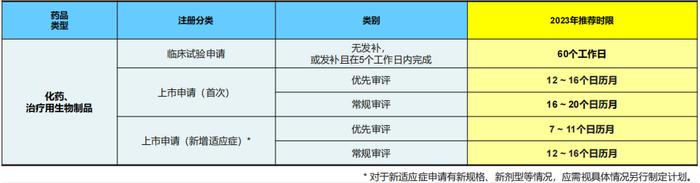
2023年基准时限的推荐是在2022年建议时限的基础上,结合本次收集到的RDPAC会员公司2022年度获批数据和对2023的时限预测(也考虑新冠疫情对注册总时限的影响),做出如上推荐。
《药品注册管理方法》中规定上市申请的常规审评品种为220工作日(技术审评200个工作日+审批20个工作日),上市申请的优先品种为140工作日(技术审评130个工作日+审批10个工作日),但考虑到:1)目前实际操作上部分注册流程用时比法规略长;2)暂停情形(不计入相关工作时限的)包括申请人补充资料、核查后整改以及按要求核对生产工艺、质量标准和说明书等所占用的时间和其它法规规定的情形(如海外核查等),这也将影响总体时限。
企业在参考此基准时限制定申请时限时,应考虑申请的具体情况,如是否需要注册检验、临床核查以及二次药检等情况。
应特别关注新核查法规带来的核查新动态对整体时限的影响。
Ref.: 2023RDPAC药品注册时限调查报告
注册圈
www.regulet.com
编辑\ 注册圈 / 来源 \ 文亮频道
