生产场地变更,比较新旧场地生产设备情况需要提交哪些资料?
2023-09-05 19:44:23 - 市场资讯
转自:蒲公英Ouryao
转自:江苏省药监局审评中心排版:水晶

问:药品上市后生产场地变更,比较新旧场地生产设备情况需要提交哪些资料?
答:
(1)变更前后生产设备的生产厂家及型号、材质、关键技术参数、设备原理等资料;
(2)基于设备的性能、关键技术参数等对比,通过批生产和/或工艺验证情况来证明生产设备与生产工艺的匹配性;
(3)按照相关药学变更研究技术指导原则要求,对设备变更管理类别进行评估,指导原则提到的变更情形包括:
①《已上市化学药品药学变更研究技术指导原则(试行)》

注:CDE于2017年发布的《已上市化学药品生产工艺变更研究技术指导原则》对于上市后变更生产设备有更为详细的分类表述,如延长总冻干时间的冻干设备的替换或增加为重大变更。
②《已上市中药药学变更研究技术指导原则(试行)》规定生产设备的选择应符合生产工艺的要求,应树立生产设备是为药品质量服务的理念,充分考虑生产设备工作原理、设备的适用性,以及可能引起的变化,评估生产设备的改变对药品质量的影响。
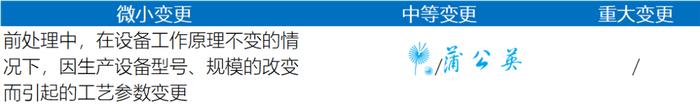
③《已上市生物制品药学变更研究技术指导原则(试行)》

