怎样的研究一直被诺奖青睐?
【编者按】在上海市科学技术委员会资助(项目编号:22DZ2304300)下,澎湃新闻联合《世界科学》对获得国家及上海市科技奖励的获奖成果进行科普化报道。
本文围绕2020年度上海市自然科学奖一等奖项目“G蛋白偶联受体结构与功能的系统性研究”展开,该奖项由上海科技大学iHuman研究所刘志杰教授领衔的研究团队获得。
时至今日,我们已经知道G蛋白偶联受体(简称GPCR)是质膜受体中最大、最普遍存在的家族之一。人类基因组中有约千个编码此类受体的基因,调控了人类生理过程中几乎所有已知的方面,例如视觉、味觉和嗅觉等感官方式等。也正因为如此,目前,FDA批准上市的药物中,约三分之一靶向GPCRs,并且这一比例仍在上升。
不难看出,这一庞大、多样化的受体家族是生命科学和医药领域极为重要的研究对象。随着对GPCRs结构和功能的深入研究,它们不仅成为药物研发的主要靶点,也为我们了解人体生理学的基本原理提供了极为重要的启示。
“受体”的探索
受体研究在当今的生物医学研究中发挥着非常重要的作用,但直到最近的三四十年,人们才普遍接受它们的存在。一个多世纪以来,细胞如何感知和响应外界刺激一直是生物学中的一个关键问题。跨越细胞膜并能够感知和转导信号的“受体假说”在今天看来是合乎逻辑的,但是当这个想法在20世纪早期首次被英国药理学家兰利(J.N.Langley)提出时,它备受争议和质疑。兰利的假设指出,受体结构具有两个相互关联的功能:首先,受体与化学物质或刺激物相互作用,大概率是通过特定的方式结合它们;其次,受体也作用于细胞内的效应器以改变它们的功能。
然而具有讽刺意味的是,虽然兰利的假设在当时并未被学界所认同,但他的学生亨利·戴尔(HenryHallettDale)却因胆碱能神经信号传递的研究于1936年获得诺贝尔奖。而现在科学家早已查明,乙酰胆碱受体是镶嵌在膜上的蛋白,其中毒蕈碱受体(M受体)就是一种GPCR。在很长一段时间里,许多科学家都“旁敲侧击”地证明着受体的存在,比如厄尔·萨瑟兰(EarlSutherland)。
20世纪40年代,萨瑟兰专注于人体处于饥饿状态下的能量代谢机制研究,开启了一系列关于肾上腺素和胰高血糖素刺激肝糖原转化为葡萄糖机制的实验。他发现,这些激素通过一种间接而复杂的机制,增加了肝脏内磷酸化酶的数量。直到1956年,他只能在完整的肝细胞中显示肾上腺素的这种功能。但是在1957年,他表明这些激素可以激活肝脏匀浆中的酶。
萨瑟兰和其同事进一步的工作表明,将肝脏匀浆离心后就可以使其中的酶失活,向离心后产生的上清液中添加激素也不能使酶恢复活性。
然而,当激素被添加到离心的细胞碎片中时,它们刺激了热稳定因子的形成,从而激活了酶。
这种因子被分离出来,被后来的人鉴定为3',5'-单磷酸腺苷,其更加广为人知的名字是环AMP(cAMP),而那个酶也被命名为腺苷酸环化酶。萨瑟兰也因为这项出色的工作获得了1971年诺贝尔生理学或医学奖。萨瑟兰的工作表明肾上腺素激活一种膜酶——腺苷酸环化酶,它合成cAMP(一种细胞内第二信使),通过涉及蛋白激酶的信号级联确保糖原的水解。
但是肾上腺素等激素、神经递质(其中很多在当时已经被识别)是如何被细胞识别的呢?
于是药理学家“伪造”了受体的概念。受体在当时仍被称作接受物质(ReceptiveSubstance)。其中一些受体,特别是肾上腺素受体和去甲肾上腺素受体(如α-和β-肾上腺素能受体)具有明确的药理学特征。然而,在20世纪60年代后期,受体仍没有生化实体。
此外,还有很多未与GPCR联系起来,但实际上却与GPCR息息相关的科学发现。比如,1967年诺贝尔生理学或医学奖颁给了发现动物感光机制的科学家。现在我们知道视紫红质或感光蛋白都属于GPCR家族成员,但当时并未将感光系统与细胞信号转导联系起来。
“感知”和“看见”GPCR
“假设”的证据已经足够充分,一些科学家也开始着手寻找这些“看不见摸不着”但又客观存在的东西,以证明它们的存在。
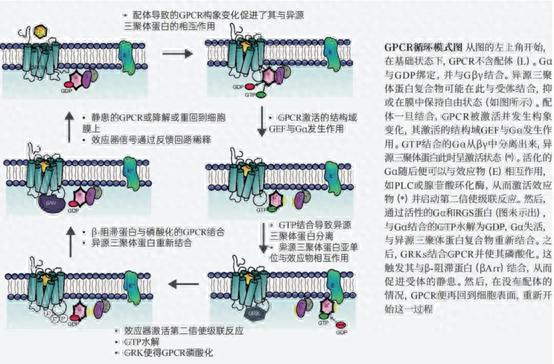
20世纪60年代,美国科学家马丁·罗德贝尔(MartinRodbell)将计算机信息加工过程与细胞信号转导过程进行类比,并细化了第二信使学说,提出了新的作用模型,即信号传递需要三类基本元件:辨别器、转换器和放大器。细胞膜上的受体作为辨别器,而cAMP引起的下游激活则可以作为放大器,二者之间的转换器即为G蛋白。1980年,阿尔弗雷德·吉尔曼(AlfredG.Gilman)将G蛋白纯化,发现它由α、β、γ三个亚基组成,因此又称为异源三聚体G蛋白。
他进一步阐明了G蛋白的作用机理:当配体与受体结合时,三聚体G蛋白解离并发生GDP与GTP的交换,游离的α-GTP处于活化开启态,导致其结合并激活效应器蛋白,从而传递信号;当α-GTP水解形成α-GDP时,则处于失活关闭态,终止信号传递并导致三聚体G蛋白重新组装,系统恢复进入静息状态。

2012年诺贝尔化学奖得主莱夫科维茨(左)和科比尔卡(右)
吉尔曼和罗德贝尔的发现揭示了G蛋白将细胞外信号转换为细胞内信号的分子机制,开创了细胞信号跨膜转导研究的新时代。同样,罗德贝尔和吉尔曼因这项出色工作获得了1994年诺贝尔生理学或医学奖。自此,G蛋白开始拥有姓名。
但是,作为“辨别器”的受体呢?它们当然不会被忽视。与此同时,还有一些优秀的科学家也在为如何“感知”和“看见”受体做着努力。
1968到1971年间,美国科学家罗伯特·莱夫科维茨(RobertJ.Lefkowitz)与学生和同事一起开发了放射性配体结合分析技术,并采用放射性标记的方法标记了糖皮质激素和肾上腺素,证明了受体独立于腺苷酸环化酶的存在。通过逐步摸索受体分离的方法,莱夫科维茨小组纯化了β-肾上腺素能受体。
几年后,他们把纯化后的、可与肾上腺素结合的细胞表面蛋白导入不响应肾上腺素的细胞后,发现细胞的表现与具有肾上腺素受体的细胞一致,这项实验结果使人们真正相信了细胞表面受体的独立存在。而且,他们还利用放射性配体结合研究多种因素对受体的调节,并发现了之前未知的受体亚型,在此基础上发展了有关受体作用机制的理论。
今天看来,克隆基因可能是一项非常简单的任务,几乎每个生化实验室都可以完成。只要可以获得纯化的肾上腺素受体蛋白,就可以通过序列测定获得蛋白的部分序列信息,从而极大地促进对肾上腺素受体的研究。但由于当时的技术限制,这项工作犹如大海捞针。即使在1984年视紫红质基因被成功克隆之后,人们仍然没有将感光受体和激素受体联系起来,而且由于激素受体表达水平极低,这项工作变得尤为困难。
1986年,布莱恩·科比尔卡(BrianK.Kobilka)作为实验室研究助理,加入并领导了这项工作。起初,这项工作非常艰难,使用cDNA(反转录DNA)文库反复尝试克隆仍然无法获得正确的结果。但是,科比尔卡提出了一个大胆的想法,尝试使用基因组文库来完成克隆任务。就是在这一年,莱夫科维茨实验室开创了一个里程碑,成功克隆并测序分析了编码仓鼠β2-肾上腺素能受体蛋白(β2AR)的基因。
经过对该基因序列的深入研究,他们惊喜地发现β2-肾上腺素能受体蛋白与牛源视紫红质蛋白的氨基酸序列有着惊人的相似性,二者都包含了七个跨膜区域。莱夫科维茨和科比尔卡敏锐地推断出视紫红质受体和β2-肾上腺素能受体可能属于同一家族,这个家族可能编码着许多重要的激素受体。随后不久,毒蕈碱乙酰胆碱受体的克隆实验进一步证实了这个推论。
在此基础上,科比尔卡等人很快成功克隆了编码人类β2-肾上腺素受体蛋白的cDNA,还克隆了编码人类β1-肾上腺素受体、人类血小板α2肾上腺素受体、5-羟色胺受体以及第一个孤儿受体等一系列受体的基因。这项工作所得到的信息和技术也为嗅觉受体这一超级家族的发现和克隆奠定了基础,最终嗅觉受体的研究工作获得了2004年诺贝尔生理学或医学奖。
除了成功克隆出各种不同的受体基因外,科比尔卡还尝试了一项大胆的工作:对肾上腺素能受体进行结晶和结构分析。这项工作在当时看来几乎是不可能的,因为GPCR蛋白丰度低、难以纯化,并且很不稳定,这些因素决定了其结晶的难度相当大。后续的故事也向我们再次证明了这一观点——随着一些新兴技术的不断发展,科比尔卡用了十几年的时间才完成了这项工作。
不过,在莱夫科维茨实验室中,科比尔卡也通过融合蛋白与拆分蛋白等方法,探究了GPCR上能够起到关键作用的区域。在斯坦福大学成立自己的实验室后,他通过使用嵌合受体和定点突变体的一系列研究继续完善GPCR功能域图谱,并且通过使用荧光光谱来表征激动剂结合和激活的机制,这些前期工作为后续研究GPCR蛋白质结构的工作奠定了坚实的基础。
2000年,视紫红质的第一个高分辨率三维结构发布,这一结构使人们清楚地看到了GPCR的七次跨膜结构,更加直观地展示了其结构域之间的互作关系。该项研究成果给科比尔卡带来了宝贵的经验,他开始逐步定义这些分子纯化、溶解和稳定所需的条件,同时他也遭遇了危机——他的研究资金受到了威胁。
成功虽迟但到。2007年,科比尔卡的研究成果迎来了爆发,他通过将GPCR与抗体共结晶和在第三个胞内环中插入溶菌酶两种方法,几乎同时获得了β2-肾上腺素能受体的晶体,其中第二种方法不仅得益于脂立方技术的发展,还与他之前从分子水平探究GPCR结构域互作的工作脱不开关系。这些结果几乎在同一时间井喷式地发表在《科学》《自然》《自然-方法》等顶级期刊上。
从此之后,他的实验室和其他几个实验室在激动剂、拮抗剂或反向激动剂存在的情况下,成功地结晶了大约50个A家族GPCR结构,甚至共结晶β2-肾上腺素能受体的完全活性形式,这些工作使人们更加全面且直观地了解了GPCR的工作原理。
因为他们的杰出工作,科比尔卡和他前任“老板”莱夫科维茨共享了2012年诺贝尔化学奖。其实诺贝尔奖此前曾多次颁给关于GPCR的研究,其中涉及受体、配体、感官、疾病等多个研究领域,但直到这次,人们对其空间结构和G蛋白的互作方式才有了清晰全面的认知。
系统揭示大麻素受体的中国科学家
解析GPCR的分子结构,不仅让我们从微观角度更加了解自己的生理结构,还以此为依据开发新的药物靶点,有着非常重要的科学与现实意义。“做科研可能是99.99%的失败,0.01%的成功,这就意味着你要坐得起‘冷板凳’,经受得住打持久战的考验,有信心有定力的人才有希望。”这是上海科技大学刘志杰教授常用来激励学生的话,也是他科研工作的真实写照。
刘志杰教授团队与其解析的大麻素受体CB1与激动剂复合物的三维结构多年来,刘志杰将研究目标锁定在与重大疾病相关的GPCR上,在多种精神和神经类疾病、疼痛及炎症、免疫调节类疾病等靶点上不断突破、硕果累累。其中一个主要方向便是系统研究大麻素受体结构与功能。
为什么大麻素受体如此值得研究?人体有11个主要的器官系统,包括循环系统、呼吸系统、泌尿系统等,所有这些系统构成了人体。此外,还存在一个内源性大麻素系统(ECS),虽然大多数人几乎没了解过它,但它非常重要——通过动态平衡调节身体,例如身体温度不能太热或太冷,血糖水平不能太高或太低等。ECS系统主要涉及三个关键部分:存在于细胞表面的大麻素受体、激活大麻素受体的内源性大麻素、分解内源性大麻素的代谢酶。大麻素受体主要包括两种——两个G蛋白偶联受体分子:CB1和CB2。CB1在中枢神经系统中更为丰富,例如,当神经元过度兴奋,内源性大麻素释放,与CB1结合,使得过度活跃的神经元安静下来。
我们熟知的大麻中的关键成分——四氢大麻酚也是与CB1结合而起作用,如果科学家能揭示其中的作用机理,挖掘大麻的治疗价值就有了可能。实际上已经有研究人员正在探索这项工作,包括探索大麻对抗癌症带来的疼痛但产生更少的副作用。近些年研究发现,可治疗抑郁症的“裸盖菇素”也可能是通过CB1在起作用。
CB2在神经系统外更丰富,包括免疫系统的细胞。当细菌或病毒感染引发免疫反应时,免疫细胞释放“促炎分子”,这些信号分子可以告诉其他免疫细胞共同加入战斗。内源性大麻素也被释放,向其他免疫细胞发出信号,在寻求帮助的同时避免过度炎症反应;在炎症结束时,促使细胞和身体返回平衡状态。因此,CB2受体被认为是治疗炎症和免疫类疾病(例如疼痛、风湿性关节炎、自身免疫疾病等)的理想靶点。
在过去几年中,刘志杰教授及研究团队系统揭示了大麻素受体的拮抗、激活及信号转导的分子机制。相关研究成果分别于2016、2017和2019年发表在《自然》和《细胞》杂志上。2023年,华甜/刘志杰团队与合作者在国际学术期刊《自然-通讯》上发表了研究论文,揭示了大麻素受体CB2在分子水平与配体结合的选择性机制。该研究为靶向CB2的药物设计提供了精准模板和理论指导。
刘志杰教授团队。
除大麻素受体,刘志杰教授团队在其他GPCR结构解析方面也取得了重要的科研成果。2017年,他们成功解析了糖尿病治疗的重要靶标GLP1受体与别构小分子的复合物的三维结构,并揭示了其拮抗机制。2023年由埃隆·马斯克带火的Ozempic就是GLP1受体激动剂。它本用来治疗糖尿病,但人们意外发现它的“副作用”——减肥颇有效。刘志杰团队的成果与这种药物的结构基础紧密相关。
除此以外,在肥胖症、精神分裂症、癌症等相关的GPCR受体结构及机制揭示上,刘志杰团队陆续都有重要发现。也因此种种重要发现,刘志杰教授团队完成的“G蛋白偶联受体结构与功能的系统性研究”项目获得了2020年度上海市自然科学奖一等奖。
值得注意的是,2022年9月16日,刘志杰教授团队在《科学》杂志上发表了苦味受体的冷冻电镜高分辨结构,成功破解了苦味受体的神秘面纱,这也是国际上首个发表的苦味受体结构。该研究填补了T类GPCR结构的空白,为探索苦味受体的结构和作用机制开创了新途径,未来还将促进针对苦味受体的化学感知和药物候选分子的探索。要知道,感觉类受体的揭示长期以来都备受诺奖青睐。
