医药政策通 | 解读《国家药监局关于进一步加强医疗器械注册人委托生产监督管理的公告》

政策背景
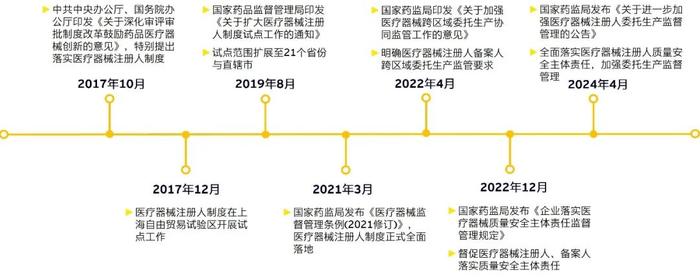
自2017年起,国家药监局逐步推行医疗器械注册人委托生产制度,通过解绑医疗器械注册和生产,推动医疗器械产业高质量发展。2024年4月2日,国家药监局发布《关于进一步加强医疗器械注册人委托生产监督管理的公告》(以下简称《公告》),进一步细化医疗器械注册人的主体责任,强化委托生产监督管理并有效防控医疗器械质量安全风险。
政策关注核心
我国于2015年在药品行业推行了药品上市许可人试点工作,为医疗器械注册人制度积累了一定的经验。通过对比《关于加强药品上市许可持有人委托生产监督管理工作的公告(2023年第132号)》,对《公告》各部分中国家对委托生产监管的关注重点进行归纳和总结。

一
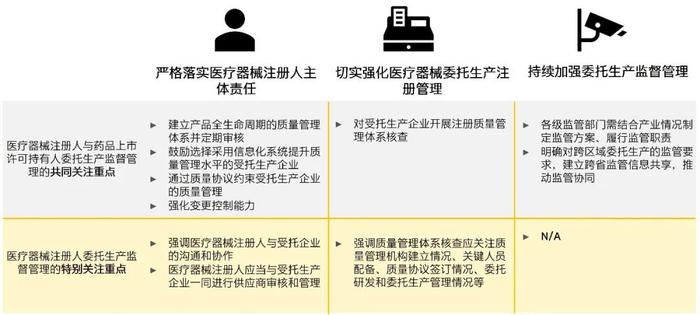
严格落实医疗器械注册人主体责任
► 1、医疗器械注册人主体责任:《公告》进一步明确医疗器械注册人的主体责任,强调无论是否进行委托生产都应建立覆盖医疗器械全生命周期的质量管理体系,保证产品全生命周期质量管理能力;《公告》明确了管理职责部门设置、专业管理人员配置,产品上市放行、管理体系运行审核、以及医疗器械注册人的责任赔偿能力等内容的要求,与药品上市许可持有人委托生产监督管理的要求相似;
► 2、受托企业选择:《公告》建议医疗器械注册人选择受托方时应当对生产企业的质量管理水平、生产规模较、信用记录、生产自动化程度及信息化管理水平进行考量,与药品上市许可持有人选择受托药品生产企业的考虑因素一致;
► 3、质量协议要求:对于医疗器械注册人和药品上市许可人,政策均要求通过签订质量协议对受托企业的质量管理进行约束,并定期对质量协议的落实和有效性进行评估。此外,《公告》还鼓励医疗器械注册人和受托企业积极商讨并在质量协议中明确双方权责、沟通机制、纠正预防控制程序和处置要求;
►4、变更控制能力:政策要求医疗器械注册人和药品上市许可人强化变更控制能力、建立更完善的变更控制体系并做好变更评估,对于医疗器械注册人,《公告》额外强调应会同受托生产企业完善变更控制体系,防控医疗器械质量安全风险;
► 5、不良事件监测:对比药品上市许可人,《公告》明确医疗器械注册人需承担不良事件监测责任,应当结合产品风险特点制定合适的监管体系,并在质量协议中约定委托双方处理不良事件的责任义务,但不得通过质量协议向受托生产企业转移《医疗器械监督管理条例》等法规规定的责任。
二
切实强化医疗器械委托生产注册管理
► 1、质量管理体系核查:政策提出医疗器械注册人和药品上市许可人应对受托生产企业开展注册质量管理体系核查,对于医疗器械注册人,《公告》进一步细化质量管理体系核查的关注重点包括企业质量管理机构建立情况、关键人员配备、质量协议签订情况,委托研发和委托生产管理情况等,并明确了境内跨区域委托生产活动应由医疗器械注册人所在地和受托企业所在地药监局进行联合检查。
三
持续加强委托生产监督管理
► 1、药品监督管理部门加强监管:对于医疗器械和药品委托生产,政策均强调各级监管部门需结合产业情况制定针对性监管方案,定期对医疗器械注册人或药品上市许可人的质量管理能力、委托生产监管情况、质量协议落实情况、变更管理能力等进行检查,及时发现问题并监督整改;
► 2、跨区域监管信息互通:对于医疗器械和药品跨区域委托生产,政策均提出相关省级药品监督管理部门应通过跨省监管信息互通建设来推动跨省监管协同,并且对于医疗器械委托生产,《公告》进一步鼓励药品监督管理部门创新监管方法,通过信息化手段在医疗器械注册人和受托企业两地同步开展监督检查,提升信息沟通有效性。
政策影响
随着《公告》的发布和实施,医疗器械行业将会面临更严格的监管,促使医疗器械注册人和委托生产企业积极做出改变,推动医疗器械行业的进一步发展。

对医疗器械注册人的影响:
1、管理能力提升:《公告》明确了医疗器械注册人的监管主体责任并细化监管内容,为医疗器械注册人制定了更高的管理要求,促使医疗器械注册人加强自身质量管理能力和质量安全责任能力并建立健全更为完善的质量管理体系。
2、与监管机构互动增多:随着监管机构加强日常监管,医疗器械注册人与监管机构间的沟通会更加密切;参考药品上市许可持有人委托生产监督管理工作,未来监管部门可能参与关键岗位人员的培训和考核,帮助医疗器械注册人持续提高质量管理水平、监管能力以及合规意识。
对委托生产企业的影响:
1、管理水平提升:为满足《公告》对产品质量的进一步要求和医疗器械注册人的需求,生产企业需要投入更多成本来加强自身质量管理能力,推动产品质量和管理水平的提升。
2、管理技术升级:《公告》建议医疗器械注册人优先选择生产自动化程度和信息化管理水平较高的企业作为受托方,促使生产企业增加对自动化和信息化技术上的投入,引导生产企业通过数字化监管系统提升自身管理水平。
对医疗器械行业的影响:
1、合作模式调整:《公告》鼓励医疗器械注册人和受托生产企业在生产过程中加强沟通和协作,共同确保产品质量安全。为加强协作,委托生产的合作模式会逐渐由订单生产模式转移向建立长期稳定的合作伙伴关系。
2、促进行业规范化发展:通过进一步细化委托生产的管理要求并加强对受托生产企业的资质审核,逐步淘汰不具备生产条件或质量管理体系不健全的企业,使整个医疗器械行业更加规范化,创造更高质量的市场环境。
