正大天晴拿下重磅抗病毒药首仿!国内增速超7倍,默沙东压力山大?
重磅进口原研药面对国产仿制药获批,带来的市场竞争压力和终端格局变化不容小觑。
日前,中国国家药品监督管理局(NMPA)官网显示,中国生物制药下属企业南京正大天晴开发的来特莫韦注射液获得上市批准,该药品成为国内首个仿制药。

来特莫韦的片剂和注射剂最早于2017年获得美国FDA的批准上市,商品名为Prevymis,这是一款备受关注的抗巨细胞病毒(CMV)新药。目前,来特莫韦相关制剂已在美国、欧洲、日本等近20个国家和地区上市销售。
根据米内网的数据显示,2024年上半年,中国公立医疗机构终端来特莫韦片的销售额突破了1亿元人民币,与去年同期相比增长了约159%。更引人注目的是,来特莫韦注射液的销售额增速更为迅猛,超过了732%。
这一显著的增长不仅反映了来特莫韦在市场上的强劲需求,也暗示了其在抗病毒治疗领域的重要性和潜力。随着南京正大天晴制药有限公司成功拿下来特莫韦注射液的国内首仿,患者无疑将拥有更多的治疗选择,也将进一步推动市场竞争。
片剂、注射剂首仿均为正大天晴默沙东如何抉择?
来特莫韦最早由德国Aicuris公司研发,2012年10月,默沙东支付1.1亿欧元的预付款和3.325亿欧元的里程碑费用从Aicuris获得来特莫韦的全球权益。
来特莫韦的上市对于接受异基因造血干细胞移植(HSCT)的CMV血清学阳性的成人受者具有重要意义。这些患者由于免疫系统受到抑制,更容易受到CMV感染的威胁,而CMV感染可能导致严重的并发症,甚至死亡。来特莫韦提供了一种预防性治疗方案,可以显著降低这些患者发生CMV感染的风险。
2022年1月6日,默沙东的来特莫韦片获得中国国家药品监督管理局批准,用于接受异基因造血干细胞移植(HSCT)的巨细胞病毒(CMV)血清学阳性的成人受者预防巨细胞病毒感染和巨细胞病毒病。同年5月16日,默沙东的来特莫韦注射液也在中国获批上市。随后,在2023年,来特莫韦片剂和注射液被纳入国家医保乙类药物目录,并从2023年3月1日起正式执行。
自这些产品推向市场以来,无论是在全球还是国内市场,销售额均呈现出显著的增长趋势。根据默沙东2023年财报显示,来特莫韦在2023年的全球销售额为6.05亿美元,同比增长41.4%。这一强劲的增长势头不仅凸显了来特莫韦在全球范围内受到的广泛认可,也反映出了市场对其的迫切需求。
随着来特莫韦的化合物专利在中国的保护期限于2024年4月到期,这一重要药物的专利独占期也随之结束。
面对这一机遇,南京正大天晴迅速行动,率先在片剂剂型获得突破。2022年10月,正大天晴提交了来特莫韦片新4类上市申请,历时近一年半于2024年4月获得了NMPA的上市批准,一举成为国内首家获得来特莫韦仿制药上市许可的企业。
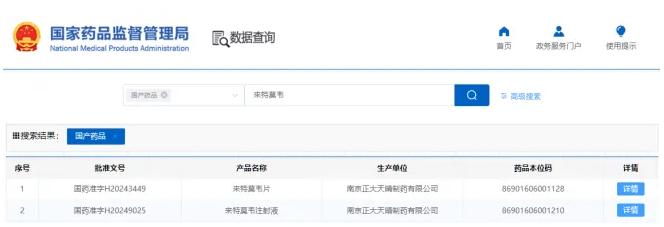
此次获批的来特莫韦注射液同样是南京正大天晴斩获首仿。事实上,来特莫韦的片剂和注射液两种剂型可以根据医生的临床判断灵活使用,对于那些对口服药物不耐受的患者,注射剂型提供了一个有效的替代方案,能够显著提高药物的吸收效率,从而更好地满足这部分患者的治疗需求。
目前,正大天晴已经成功获得了这两种剂型的首仿批准,不仅丰富了自己的产品线,而且有望对跨国企业的市场份额发起有力的挑战,为国内患者提供更多高质量、价格合理的治疗选择。
国产仿制药汹涌来袭大药企纷纷布局
在抗病毒药物市场中,来特莫韦作为一种新型非核苷巨细胞病毒(CMV)抑制剂,因其独特的作用机制和显著的疗效,受到了广泛关注。随着来特莫韦化合物专利在中国的保护期限于2024年4月到期,国内多家药企纷纷布局,以期在这一领域分得一杯羹。
除了正大天晴成功拿下来特莫韦片和来特莫韦注射液的国内首仿外,其他国内药企也在积极布局这一领域。
根据CDE官网信息,齐鲁制药、重庆希韦医药科技等企业已经提交了来特莫韦片的仿制药上市申请,目前这些申请均在审评审批中。
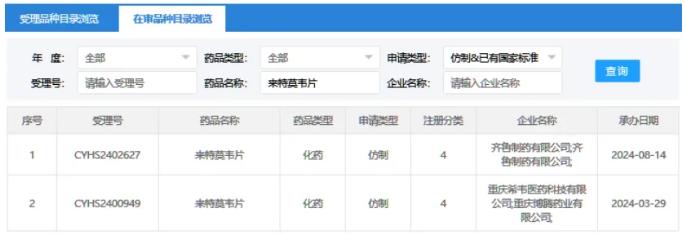
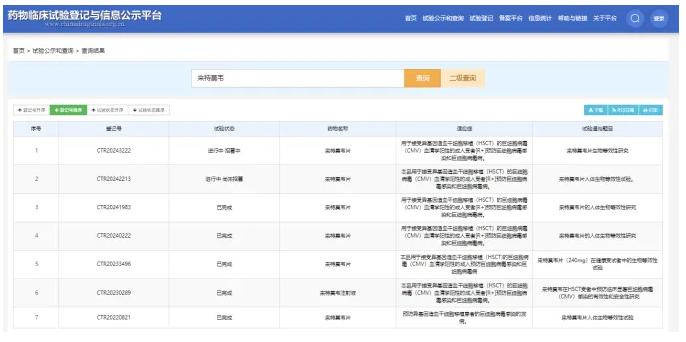
在临床试验方面,正大天晴制药、重庆希韦医药、齐鲁制药、浙江海正药业以及江西迪赛诺医药集团都开展了来特莫韦片的生物等效性研究。其中,正大天晴、重庆希韦医药和齐鲁制药的试验已完成,而浙江海正药业和江西迪赛诺医药集团的等效性研究正在进行。
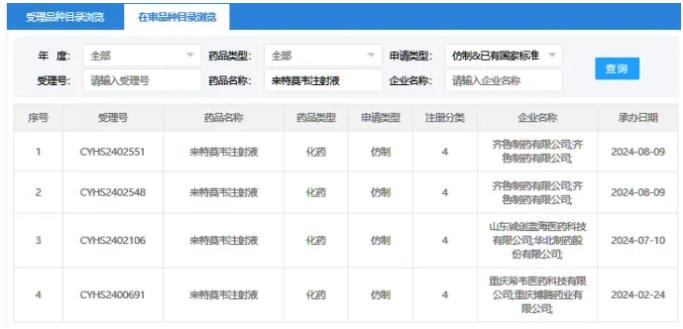
对于来特莫韦注射液,齐鲁制药、山东诚创蓝海医药、重庆希韦医药等企业也提交了来特莫韦注射液的4类仿制申请,同样在审评审批中。
这些进展表明,来特莫韦的市场竞争力正在迅速增强。
行业观点认为,随着多家企业的积极布局,来特莫韦市场即将迎来更激烈的竞争。仿制药的陆续获批上市,预计将推动来特莫韦价格下降,同时为患者提供更多样化的用药选择。这一趋势可能侵蚀默沙东原研药的市场份额,但无疑将提升药物的可及性,并有助于降低医疗成本,未来患者有望享受到更多高质量、价格合理的治疗选择。
编辑:艾伦
