药物设计常用策略之骨架跃迁
转自:药时代
药物研发时间、提高研发成功率并节约研发成本。传统的药物设计方法包括生物电子等排、分子杂交、构象限制、骨架跃迁等。今天向大家介绍药物化学家们常用的骨架跃迁策略,该策略已成功应用于临床前及临床/上市药物的开发。

什么是骨架跃迁
1999年,ETH的计算机辅助药物设计专家GisbertSchneider提出了“骨架跃迁”的概念,用于形容具有不同分子骨架的同功能化学结构。此后,骨架跃迁越来越多地用于小分子药物发现,它提供了一种新的药物设计方法,将已知活性化合物的主骨架进行合理替换,产生与母体化合物3D结构相似,但具有潜在更优特性、可专利的新分子。骨架跃迁也被称为先导跃迁、骨架搜索、骨架变形。

GisbertSchneider
在药物、临床候选药物和临床前活性分子的结构修饰中,经常可以看到各种形式的骨架跃迁策略,对分子主骨架进行替换的同时保留关键的作用基序。常用的骨架跃迁策略包括杂环取代、开环/闭环、伪肽和拟肽以及基于拓扑形状的骨架跃迁。
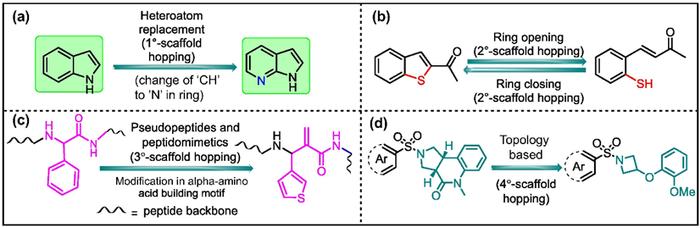
杂环取代是架跃迁的最简单形式,涉及取代或替换活性分子结构中核心的杂/碳环主链中的碳原子和杂原子,同时保持药效基团几乎不发生改变(图1a)。一般来说,这种策略可以获得保持关键配体-靶标结合相互作用的新化学结构,并且可以改善化合物理化性质和PK特性。
环的打开和闭合通过改造化学结构中的环来构建新颖的骨架(图1b)。闭环可以通过减少不必要的构象灵活性来避免脱靶相互作用。开环则可以增加类似物的柔性以允许更有效地结合到靶标口袋。该策略同样可以改善药物特性,包括膜的渗透性、溶解度和吸收。
伪肽和肽模拟物则是通过对强生物活性的内源蛋白进行结构模拟,用非肽的结构替换内源蛋白的易代谢肽主链,来提高化合物的代谢稳定性和生物利用度(图1C)。
基于拓扑形状的骨架跃迁是结构变化最大的骨架跃迁策略,生成了一个全新的分子骨架,但同时保留配体与靶标的分子相互作用(图1d)。在此类别中,原有结构基序被替换为可以显示相似的结合特性、3D形状和电势特征的适当基团。这种新的化学结构主要是通过计算机辅助设计产生的,因此,基于拓扑形状的骨架跃迁有时也被称为基于结构的虚拟筛选。

骨架跃迁的成功案例:从上市药物到上市药物
著名药理学家、诺贝尔医学奖获得者詹姆斯·怀特·布莱克曾说,“发现新药最富有成果的方法是从旧药开始”。越来越多例子表明,基于旧药物的分子结构,使用骨架跃迁策略是一种十分有效的新药开发手段。"
2018年,FibroGen和AstellasPharmaInc.合作开发了缺氧诱导因子(HIF)脯氨酰羟化酶(PHD)抑制剂Roxadustat(IIa),该分子具有异喹啉核心骨架,用于治疗与慢性肾病相关的症状性贫血。AkebiaTherapeuticsInc.通过用吡啶环对Roxadustat的异喹啉母核进行替换,同时保留了其他主要分子特征,获得了Vadadustat(IIb)。Vadadustat对人PHD1、2和3的Ki值分别为0.19、0.26和0.56nM,均显著优于Roxadustat,同时也具有更短的半衰期和更高的生物利用度,最终于2020年6月获得日本PMDA批准上市。
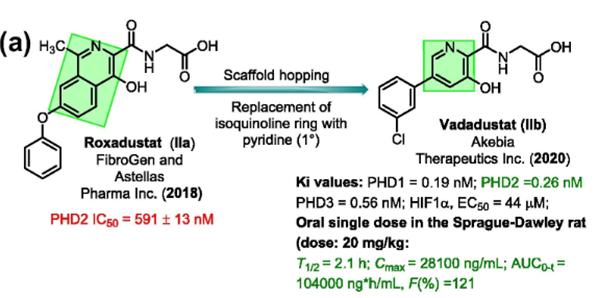
从Roxadustat到Vadadustat的骨架跃迁
吉非替尼(Iressa™)(IIc)由阿斯利康开发,是第一个表皮生长因子受体(EGFR)抑制剂,用于治疗乳腺癌、肺癌和其他某些类型的癌症。
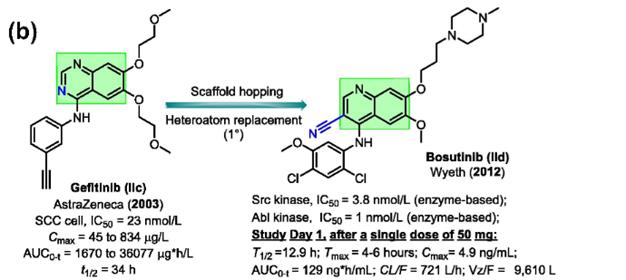
从吉非替尼到博舒替尼的骨架跃迁

骨架跃迁的成功案例:从上市药物到临床试验药物
同样还是Roxadustat,共晶结构(PDB:2G19)显示,3-羟基吡啶甲酰甘氨酸是Roxadustat结合PHD2催化位点的关键药效团,其关键作用力包括与亚铁离子的双齿配位键、羧基与Arg383之间的离子键,以及酚羟基与Tyr303之间的氢键。Zang等人通过骨架跃迁的方式,将异喹啉母核替换为刚性且线性的5-炔基吡啶母核(IIIb),得到了一类具有新结构的PHD2抑制剂,其活性提升接近10倍,口服生物利用度也达到了54%,具有比Roxadustat更高的安全性和PK特性,目前正处于I期临床试验当中。
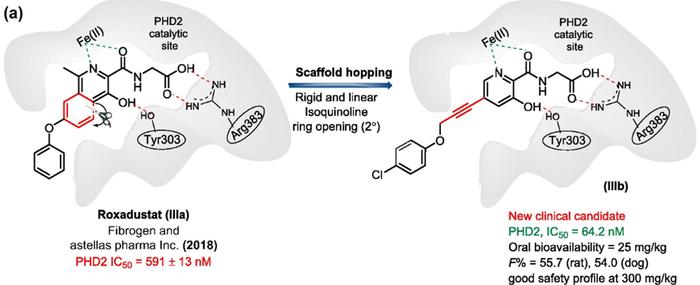
基于Roxadustat的骨架跃迁
西那卡塞(Cinacalcet,IIIc)由NPSPharmaceuticalsInc,作为一种上市的拟钙剂,能激活甲状旁腺中的钙受体,从而降低甲状旁腺素(PTH)的分泌,进而降低血浆钙离子浓度,用于接受透析的慢性肾病病人的甲状旁腺功能亢进症。由于其cLogP和pKa均较高,导致PK性质不佳。LupinPharmaceutical在西那卡塞的基础上采用骨架跃迁的策略,引入新的环系以及杂原子,开发出了LNP1892(IIId),cLogP和pKa均明显降低,并在I期临床试验显示出出色的安全性和PK特性,目前正处于II期临床试验中(NCT02174237)。
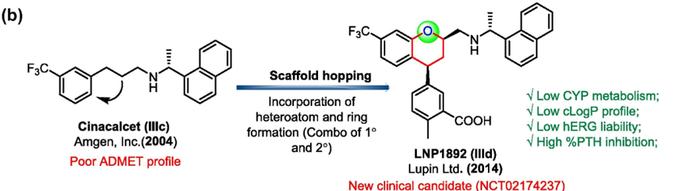
从Cinacalcet到LNP1892的骨架跃迁
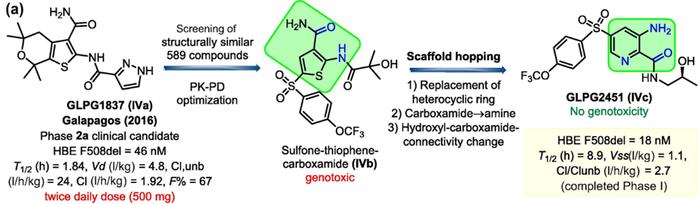

骨架跃迁的成功案例:从临床试验药物到临床试验药物
GLPG1837(IVa)是一种囊性纤维化跨膜电导因子(CFTR)的增强剂,可通过增加细胞表面CFTR蛋白的门控活性来增加缺陷型CFTR蛋白的功能,已在携带G551D突变的囊性纤维化(CF)患者中完成了IIa期临床试验(NCT02707562),虽然它表现出很高的CFTR活性,但需要每天两次500mg的高剂量才能获得与标准治疗药物Ivacaftor相当的CFTR活性。基于GLPG1837和ivacaftor的结构,研究人员进一步优化出一个基砜-噻吩-甲酰胺(IVb)骨架分子,但该系列结构均有较强的遗传毒性。于是通过骨架跃迁策略将2-氨基噻吩-3-甲酰胺母核替换为3-氨基吡啶酰胺骨架,该骨架不仅保持了原2-氨基噻吩-3-甲酰胺的分子内氢键,保留分子的平面性,同时完全消除了原分子的遗传毒性,并具有良好的CFTR活性和PK特性(T1/2=8.9h,Vss=1.1l/kg,Cl/Clunb=2.7升/小时/千克)。

骨架跃迁的成功案例:从表型筛选Hit到临床试验药物
通过对化合物库的抗抗沃尔巴克氏体活性筛选得到了噻吩并嘧啶化合物AWB124(Vd),其EC50达到了29nM。将其作为先导化合物进行骨架跃迁得到了化合物Ve,用苯环替换了噻吩环,溶解度从3.7μM提升到25μM,但活性下降,再用吡啶替换化合物Ve的苯环,并对其他取代基进行SAR优化,得到化合物Vf,活性较Vd提升10倍,溶解度提升接近70倍。在沃尔巴克氏体感染模型进行的动物体内研究中,Vf杀灭了超过90%的沃尔巴克氏体。因此,其被确定为一流、高效、特异性的抗沃尔巴克氏体药物,并已进入I期临床试验(NCT05084560)。
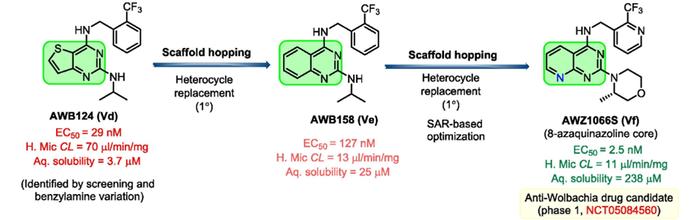
骨架跃迁策略之所以重要,主要有以下三个原因:(i)如果开发项目中现有的先导系列分子表现出较差的ADMET和PK特性,骨架跃迁可以为改研究项目提供备选分子;(ii)原始分子中的骨架/环合成起来很困难时,骨架跃迁策略可以提供预期相似的易合成分子;(iii)能够提供不被现有专利覆盖的全新药物分子。因此,在平时的药物设计开发中有意识的使用骨架跃迁等策略,将能帮助我们改善现有分子特性、获取全新分子骨架并最终发现优良的候选药物分子。
参考:
1.https://en.wikipedia.org/wiki/Gisbert_Schneider
2.ChenNetal.RoxadustatforAnemiainPatientswithKidneyDiseaseNotReceivingDialysis.NEnglJMed.2019Sep12;381(11):1001-1010.
3.LangdonSRetal.BioisostericReplacementandScaffoldHoppinginLeadGenerationandOptimization.MolInform.2010May17;29(5):366-85.
4.NakanoHetal.SparseTopologicalPharmacophoreGraphsforInterpretableScaffoldHopping.JChemInfModel.2021Jul26;61(7):3348-3360.
5.AcharyaAetal.Molecularmedicinalinsightsintoscaffoldhopping-baseddrugdiscoverysuccess.DrugDiscovToday.2024Jan;29(1):103845.
