HER2阳性乳腺癌的HER2异质性及其临床意义
转自:医学界
人表皮生长因子受体2(HER2)在大约15%-20%的乳腺癌中过表达[1],这类乳腺癌具有更强的侵袭性,因而患者的预后更差。但HER2过表达的乳腺癌对抗HER2治疗敏感,对应开发出多款抗HER2治疗药物,包括单克隆抗体(单抗,如曲妥珠单抗、帕妥珠单抗)、酪氨酸激酶抑制剂(TKI,如拉帕替尼、图卡替尼)和抗体偶联药物(ADC,如T-DM1、T-DXd)等,这些HER2靶向药物显著改善HER2阳性乳腺癌患者的不良临床结局并且重塑了乳腺癌的诊疗格局。
越来越多的研究表明,HER2表达在可能在同一个肿瘤病灶(瘤内空间异质性)和不同肿瘤部位(瘤间空间异质性)以及治疗过程中(时间异质性)存在差异。这种空间和时间的HER2异质性,可能影响抗HER2治疗的治疗应答和耐药。尽管定义和表征HER2异质性当前还存在诸多挑战,但应用其作为预测标志物有助于指导治疗方案的调整。近期,一项发表在TrendsinCancer期刊的一篇综述总结了接受HER2靶向治疗的乳腺癌等实体瘤中HER2异质性的生物学和临床意义的证据,并为提升HER2异质性评估方法和HER2异质性肿瘤的治疗策略进行介绍[2]。特此整理乳腺癌相关重点内容,以飨读者。
HER2阳性乳腺癌的HER2异质性
乳腺癌中HER2阳性的评估依据美国临床肿瘤学会(ASCO)/美国病理学会(CAP)的指南[3]。HER2阳性的乳腺癌被定义为免疫组织化学(IHC)为3+,或IHC2+且原位杂交(ISH)扩增。具体而言,IHC3+的判读标准是“>10%的肿瘤细胞呈现完整的细胞膜强染色”,而2+的判读标准是“在>10%的肿瘤细胞中观察到弱到中度的完整细胞膜染色”。由于并不要求100%的肿瘤细胞膜染色,HER2阳性乳腺癌可能存在瘤内异质性,尤其是在IHC和/或ISH得到的HER2检测结果为状态不明时,可在高达30%的病例中观察到瘤内异质性[4-7]。对于这种复杂情况,ASCO/CAP指南规定,如果相邻细胞中>10%的另一个细胞群存在升高的HER2信号/细胞,必须对该细胞群进行评估和报告[3]。
HER2的空间分布可以描述为三种模式:(1)“clustered”型(成簇型),其特点是两个明显不同的肿瘤克隆,一个为HER2扩增,另一个具有正常的HER2状态;(2)“mosaic”型(嵌合型),不同HER2状态的细胞弥散混合在一起;(3)“scattered”型(分散型),HER2扩增的细胞孤立地存在于HER2阴性肿瘤细胞群中(图1)[8,9]。这些不同HER2分布模式的临床意义尚不明确,仍需进一步评估。
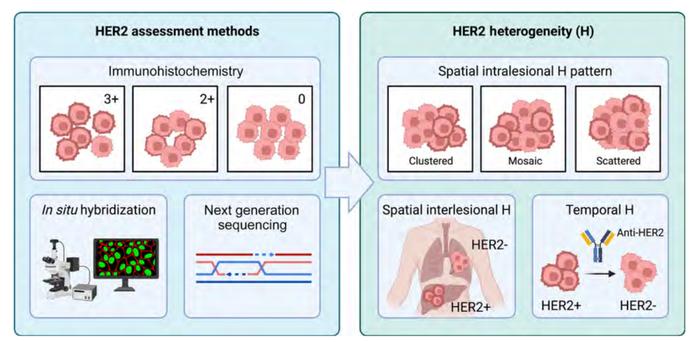
评估HER2异质性预后作用的临床前和临床研究表明,HER2异质性可能与较差的预后相关,尤其是在激素受体(HR)阴性/HER2阳性乳腺癌患者中(这类患者不依赖HR信号通路)[4,5,10-12]。
HER2异质性影响抗HER2治疗在HER2阳性晚期乳腺癌中的疗效
众多详实数据表明,存在HER2瘤内异质性的肿瘤对抗HER2治疗具有更差的治疗应答。基于IHC、ISH和mRNA定量评估等技术,多项研究对此进行过生物标志物分析。例如,在比较恩美曲妥珠单抗(T-DM1)、T-DM1+帕妥珠单抗和曲妥珠单抗+紫杉醇一线治疗HER2阳性晚期乳腺癌的MARIANNE试验中,HER2mRNA高表达水平(>中位数)的肿瘤患者无论接受哪一种方案的治疗,报告的无进展生存期(PFS)均更长(曲妥珠单抗+紫杉醇:15.9个月vs12.4个月;T-DM1:18.6个月vs10.2个月;T-DM1+帕妥珠单抗:18.7个月vs14.5个月)[13]。此外,与曲妥珠单抗+紫杉醇组相比,局部的HER2表达与T-DM1组较短的PFS相关(6.4个月vs12.4个月),这表明含化疗的方案在治疗异质性肿瘤时可能具有优势。在EMILIA和TH3RESA两项试验的生物标志物分析中,较高水平的HER2mRNA(超过中位数)与T-DM1用于二线治疗和三线治疗具有较长的PFS相关[14,15]。这一发现表明,HER2mRNA水平低于中位数的肿瘤对HER2依赖性较低且异质性更强,可能与对HER2靶向治疗的应答较差相关。
HER2阳性早期乳腺癌的治疗也受到HER2异质性的影响
在早期HER2阳性乳腺癌中,一项针对无化疗的抗HER2新辅助治疗的回顾性研究分析了基于HER2扩增比预测患者获得病理学完全缓解(pCR)的可能性。HER2扩增比通过比较每个细胞核中17号染色体ERBB2和着丝粒(CEP17)的拷贝数,量化ERBB2基因的拷贝数[16]。在这项研究中,相较于HER2扩增比为5.5的患者,HER2扩增比为13.1的患者达到pCR的概率更高(73%vs38%;OR=4.14;P=0.012)。同样,在一项纳入接受新辅助化疗+曲妥珠单抗治疗患者的研究中,HER2拷贝数的变化似乎能够预测pCR[17]。此外,在WSG-ADAPT-HER2+/HR–试验中,早期HR阴性/HER2阳性乳腺癌患者在接受无化疗新辅助抗HER2治疗后的pCR比例与HER2IHC状态有关(3+vs2+/ISH扩增:40%vs0%)[18]。HER2表达水平较高与抗HER2治疗的应答之间的相关性表明这些生物标志物(例如IHC、HER2扩增比、HER2拷贝数改变)不仅仅可以测量HER2表达的增加,还能检测到HER2的异质性(识别HER2阳性肿瘤中HER2水平较低的情况)。
在比较T-DM1+帕妥珠单抗与曲妥珠单抗+帕妥珠单抗+紫杉醇用于新辅助治疗的KRISTINE试验中,未能证明无化疗方案的无事件生存期(EFS)更优[19]。实验组中较高的EFS事件风险主要来自手术前发生的15例(6.7%)局部进展患者(对照组为0)。与同组其他患者相比,这15例患者的肿瘤组织样本HER2mRNA的表达较低(中位数:1.3vs6.2),非均一性肿瘤的比例较高(80%vs15%;定义为IHCHER2细胞染色<80%的肿瘤)。值得注意的是,非均一性肿瘤与两组中均较低的pCR率相关,表明异质性可能是一种普遍的治疗耐药机制,尤其是在仅使用靶向治疗时更加显著[20]。
一项针对164例HER2阳性早期乳腺癌患者的II期临床试验旨在评估HER2异质性对pCR的影响,这些患者接受了无化疗的T-DM1和帕妥珠单抗新辅助治疗[21]。在基线时进行了两次空间上独立的活检,并通过ISH进行评估。HER2异质性被定义为在一个肿瘤细胞区域内ERBB2扩增占浸润性肿瘤细胞的5%-50%,或者是一个区域的肿瘤通过FISH检测为HER2阴性。异质性肿瘤占总体病例的10%,与非异质性肿瘤相比,其pCR率较低(0%vs55%;P=0.0001),且IHC3+的比例也较低(25%vs81%)。总的来说,ERBB2非扩增细胞的总体肿瘤比例是导致治疗应答不佳的原因,而不是局部病灶区域的高比例ERBB2非扩增细胞。
总的来说,HER2阳性乳腺癌中的瘤内异质性是对HER2靶向治疗应答的不良预测因素,是一种可能的耐药机制。尽管缺乏比较性研究,异质性的HER2阳性乳腺癌可能会从HER2靶向药物+化疗以及可裂解连接子ADC药物中受益,如T-DXd(但不是T-DM1)。这些新一代ADC药物可将化疗药物(载药)靶向释放至周围的HER2阴性细胞中,发挥“旁观者”杀伤效应,从而克服与异质性相关的耐药性[22,23]。相反,对于均质的HER2阳性乳腺癌患者,可能会受益于减少细胞毒药物的应用而增加靶向癌基因药物的降阶梯治疗。
HER2阳性乳腺癌还表现出瘤间和时间异质性[24,25]。在治疗的影响下,HER2状态可能从阳性转为阴性,或由阴性转为阳性,当从原发肿瘤发展为转移性复发肿瘤时,5%-15%的病例可能发生HER2状态的转变[26–28]。例如,HER2丢失被认为是对HER2靶向治疗的一种耐药机制。相反,在HR阳性/HER2阴性乳腺癌患者中,在内分泌治疗的影响下,由于HER2和HR途径之间的交叉影响,HER2途径可能被活化[7]。这些表型转变进一步增加管理HER2阳性乳腺癌患者的难度,因为患者可能需要重新进行活检以捕捉这些动态变化。
HER2异质性的检测和应对策略的展望
实体肿瘤中的HER2异质性变化可能是HER2过表达肿瘤患者对HER2靶向治疗应答和耐药的决定因素。在定义、表征和治疗调整方面,HER2异质性带来许多挑战(图2)[29]。
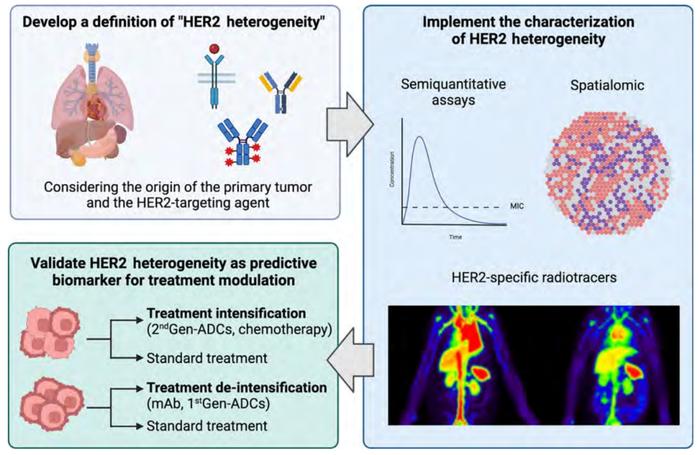
HER2异质性无法真正被纳入泛组织的药物开发范畴,因为其发生率和预测价值会根据原发肿瘤而变化。因此,对“HER2异质性”的标准化分类不应以泛组织进行定义,因为仍然需要基于组织和相关分子考量以确定肿瘤治疗的最终作用和获益。
此外,目前通过IHC和ISH进行HER2评估的方法存在许多分析前的限制(例如,冷缺血时间和标本固定时间的长短,使用的抗体等),有时还存在较低的可重复性。根据原发肿瘤和药物类型,需要更为灵敏和半定量的检测方法,以更好地定义肿瘤内部异质性,从而更好地区分对HER2靶向治疗的应答者和非应答者[30]。此外,数字病理和机器学习算法正在推动“空间组学”的发展,这将提供关于HER2表达细胞的定性分布的预测信息[22]。通过新型正电子发射断层扫描(PET)示踪,如HER2特异性放射性示踪,可能提升对瘤内和时间异质性的评估[31]。在这方面,ZEPHIR试验证明在治疗前使用89Zr-曲妥珠单抗进行PET检测能够识别出HER2异质性并预测HER2阳性转移性乳腺癌患者对T-DM1的应答[32]。此外,基于影像学的机器学习放射学等人工智能方法有希望预测HER2异质性和对抗HER2疗法的应答[33-35]。
因此,基于更好地识别HER2异质性,可以相应的调整治疗方案,对于均质性肿瘤患者进行降阶梯治疗,而对于存在瘤内/瘤间异质性的患者进行升阶梯治疗。在这方面,PHERGain研究探索的“体内分析方法”,对于HER2阳性早期乳腺癌患者接受新辅助曲妥珠单抗和帕妥珠单抗治疗,如果患者在两个治疗周期后PET无缓解和/或有残留病灶,则在治疗方案中加入化疗,这部分患者可能对应的具有肿瘤异质性[36]。该研究在未接受化疗的86名患者中,3年无浸润性疾病生存率为98.8%,这些患者被认为是在治疗期间被筛选出来的具有更加均质性且更依赖于HER2的肿瘤。除了使用化疗进行强化治疗之外,在治疗次序中更早引入新一代ADC药物也是克服异质性的有效方法[37]。基于这些,HER2的时间和空间异质性是一种有前景的预测性生物标志物,但需在前瞻性临床试验中验证其临床应用价值。
参考文献:
[1]GionM,TrapaniD,CortésA,etal.SystemicTherapyforHER2-PositiveMetastaticBreastCancer:MovingIntoaNewEra.AmSocClinOncolEducBook.2022;42:1-11.
[2]ValenzaC,GuidiL,BattaiottoE,etal.TargetingHER2heterogeneityinbreastandgastrointestinalcancers.TrendsCancer.2023Nov25:S2405-8033(23)00229-7.
[3]WolffAC,SomerfieldMR,DowsettM,etal.HumanEpidermalGrowthFactorReceptor2TestinginBreastCancer:ASCO-CollegeofAmericanPathologistsGuidelineUpdate.JClinOncol.2023;41(22):3867-3872.
[4]SeolH,LeeHJ,ChoiY,etal.IntratumoralheterogeneityofHER2geneamplificationinbreastcancer:itsclinicopathologicalsignificance.ModPathol.2012;25(7):938-948.
[5]LeeHJ,SeoAN,KimEJ,etal.HER2heterogeneityaffectstrastuzumabresponsesandsurvivalinpatientswithHER2-positivemetastaticbreastcancer.AmJClinPathol.2014;142(6):755-766.
[6]HouY,NittaH,WeiL,etal.HER2intratumoralheterogeneityisindependentlyassociatedwithincompleteresponsetoanti-HER2neoadjuvantchemotherapyinHER2-positivebreastcarcinoma.BreastCancerResTreat.2017;166(2):447-457.
[7]HamiltonE,ShastryM,ShillerSM,RenR.TargetingHER2heterogeneityinbreastcancer.CancerTreatRev.2021;100:102286.
[8]HannaWM,RüschoffJ,BilousM,etal.HER2insituhybridizationinbreastcancer:clinicalimplicationsofpolysomy17andgeneticheterogeneity.ModPathol.2014;27(1):4-18.
[9]HouY,NittaH,LiZ.HER2IntratumoralHeterogeneityinBreastCancer,anEvolvingConcept.Cancers(Basel).2023;15(10):2664.
[10]BartlettAI,StarcyznskiJ,RobsonT,etal.HeterogeneousHER2geneamplification:impactonpatientoutcomeandaclinicallyrelevantdefinition.AmJClinPathol.2011;136(2):266-274.
[11]KurozumiS,PadillaM,KurosumiM,etal.HER2intratumoralheterogeneityanalysesbyconcurrentHER2geneandproteinassessmentfortheprognosisofHER2negativeinvasivebreastcancerpatients.BreastCancerResTreat.2016;158(1):99-111.
[12]vanMackelenberghMT,LoiblS,UntchM,etal.PathologicCompleteResponseandIndividualPatientPrognosisAfterNeoadjuvantChemotherapyPlusAnti-HumanEpidermalGrowthFactorReceptor2TherapyofHumanEpidermalGrowthFactorReceptor2-PositiveEarlyBreastCancer.JClinOncol.2023;41(16):2998-3008.
[13]PerezEA,deHaasSL,EiermannW,etal.RelationshipbetweentumorbiomarkersandefficacyinMARIANNE,aphaseIIIstudyoftrastuzumabemtansine±pertuzumabversustrastuzumabplustaxaneinHER2-positiveadvancedbreastcancer[publishedcorrectionappearsinBMCCancer.2019Jun24;19(1):620].BMCCancer.2019;19(1):517.
[14]KimSB,WildiersH,KropIE,etal.RelationshipbetweentumorbiomarkersandefficacyinTH3RESA,aphaseIIIstudyoftrastuzumabemtansine(T-DM1)vs.treatmentofphysician'schoiceinpreviouslytreatedHER2-positiveadvancedbreastcancer.IntJCancer.2016;139(10):2336-2342.
[15]BaselgaJ,LewisPhillipsGD,VermaS,etal.RelationshipbetweenTumorBiomarkersandEfficacyinEMILIA,aPhaseIIIStudyofTrastuzumabEmtansineinHER2-PositiveMetastaticBreastCancer[publishedcorrectionappearsinClinCancerRes.2018Nov1;24(21):5486].ClinCancerRes.2016;22(15):3755-3763.
[16]LanderEM,RappazzoKC,HuangLC,etal.UsingtheHER2/CEP17FISHRatiotoPredictPathologicCompleteResponseFollowingNeoadjuvantAnti-HER2DoubletTherapyinHER2+BreastCancer.Oncologist.2023;28(2):123-130.
[17]RyeIH,TrinhA,SaetersdalAB,etal.Intratumorheterogeneitydefinestreatment-resistantHER2+breasttumors.MolOncol.2018;12(11):1838-1855.
[18]NitzU,GluzO,GraeserM,etal.De-escalatedneoadjuvantpertuzumabplustrastuzumabtherapywithorwithoutweeklypaclitaxelinHER2-positive,hormonereceptor-negative,earlybreastcancer(WSG-ADAPT-HER2+/HR-):survivaloutcomesfromamulticentre,open-label,randomised,phase2trial.LancetOncol.2022;23(5):625-635.
[19]HurvitzSA,MartinM,JungKH,etal.NeoadjuvantTrastuzumabEmtansineandPertuzumabinHumanEpidermalGrowthFactorReceptor2-PositiveBreastCancer:Three-YearOutcomesFromthePhaseIIIKRISTINEStudy.JClinOncol.2019;37(25):2206-2216.
[20]deHaasS,etal.biomarkeranalysisfromtheneoadjuvantKRISTINEstudyinHER2-positiveearlybreastcancer(EBC).CancerRes.2017;77(AbstractP6-07-09)
[21]FilhoOM,VialeG,SteinS,etal.ImpactofHER2HeterogeneityonTreatmentResponseofEarly-StageHER2-PositiveBreastCancer:PhaseIINeoadjuvantClinicalTrialofT-DM1CombinedwithPertuzumab.CancerDiscov.2021;11(10):2474-2487.
[22]MoseleF,DelucheE,LusqueA,etal.TrastuzumabderuxtecaninmetastaticbreastcancerwithvariableHER2expression:thephase2DAISYtrial.NatMed.2023;29(8):2110-2120.
[23]CortésJ,KimSB,ChungWP,etal.TrastuzumabDeruxtecanversusTrastuzumabEmtansineforBreastCancer.NEnglJMed.2022;386(12):1143-1154.
[24]OgitaniY,HagiharaK,OitateM,NaitoH,AgatsumaT.BystanderkillingeffectofDS-8201a,anovelanti-humanepidermalgrowthfactorreceptor2antibody-drugconjugate,intumorswithhumanepidermalgrowthfactorreceptor2heterogeneity.CancerSci.2016;107(7):1039-1046.
[25]VanRaemdonckE,FlorisG,BertelootP,etal.Efficacyofanti-HER2therapyinmetastaticbreastcancerbydiscordanceofHER2expressionbetweenprimaryandmetastaticbreastcancer.BreastCancerResTreat.2021;185(1):183-194.
[26]WalterV,FischerC,DeutschTM,etal.Estrogen,progesterone,andhumanepidermalgrowthfactorreceptor2discordancebetweenprimaryandmetastaticbreastcancer.BreastCancerResTreat.2020;183(1):137-144.
[27]vandeVenS,SmitVT,DekkerTJ,NortierJW,KroepJR.DiscordancesinER,PRandHER2receptorsafterneoadjuvantchemotherapyinbreastcancer.CancerTreatRev.2011;37(6):422-430.
[28]CuriglianoG,BagnardiV,VialeG,etal.Shouldlivermetastasesofbreastcancerbebiopsiedtoimprovetreatmentchoice?.AnnOncol.2011;22(10):2227-2233.
[29]TrapaniD,FranzoiMA,BursteinHJ,etal.Risk-adaptedmodulationthroughde-intensificationofcancertreatments:anESMOclassification.AnnOncol.2022;33(7):702-712.
[30]GustavsonM,etal.novelapproachtoHER2quantification:digitalpathologycoupledwithAI-basedimageanddataanalysisdeliversobjectiveandquantitativeHER2expressionanalysisforenrichmentofresponderstotrastuzumabderuxtecan(T-DXd;DS-8201),specificallyinHER2-lowpatients.CancerRes.2021;81AbstractPD6-01.
[31]McGaleJ,KhuranaS,HuangA,etal.PET/CTandSPECT/CTImagingofHER2-PositiveBreastCancer.JClinMed.2023;12(15):4882.
[32]GebhartG,LambertsLE,WimanaZ,etal.MolecularimagingasatooltoinvestigateheterogeneityofadvancedHER2-positivebreastcancerandtopredictpatientoutcomeundertrastuzumabemtansine(T-DM1):theZEPHIRtrial.AnnOncol.2016;27(4):619-624.
[33]BitencourtAGV,GibbsP,RossiSaccarelliC,etal.MRI-basedmachinelearningradiomicscanpredictHER2expressionlevelandpathologicresponseafterneoadjuvanttherapyinHER2overexpressingbreastcancer.EBioMedicine.2020;61:103042.
[34]HuangZ,ShaoW,HanZ,etal.Artificialintelligencerevealsfeaturesassociatedwithbreastcancerneoadjuvantchemotherapyresponsesfrommulti-stainhistopathologicimages.NPJPrecisOncol.2023;7(1):14.Published2023Jan27.
[35]VandenbergheM.E,etal.RelevanceofdeeplearningtofacilitatethediagnosisofHER2statusinbreastcancer.Sci.Rep.2017;745938.
[36]CortesJ,etal.3-yearinvasivedisease-freesurvival(iDFS)ofthestrategy-based,randomizedphaseIIPHERGaintrialevaluatingchemotherapy(CT)de-escalationinhumanepidermalgrowthfactorreceptor2-positive(HER2[+])earlybreastcancer(EBC).J.Clin.Oncol.2023;41LBA506.
[37]GuidiL,PellizzariG,TarantinoP,ValenzaC,CuriglianoG.ResistancetoAntibody-DrugConjugatesTargetingHER2inBreastCancer:MolecularLandscapeandFutureChallenges.Cancers(Basel).2023;15(4):1130.
*本材料由阿斯利康提供,仅供医疗卫生专业人士参考
审批编号:CN-127078 有效期至:2024-12-20
