北京协和医学院的研究者们揭示了靶向肿瘤干细胞的铁死亡代谢可提高肺癌免疫治疗的疗效
转自:生物谷
肺癌是癌症相关死亡的主要原因,其中,非小细胞肺癌(NSCLC)占病例的80%。尽管分子靶向治疗和免疫治疗可用于肺癌患者,但由于耐药导致的复发和疾病进展很常见。肿瘤干细胞(CSCs)是肿瘤起始、耐药和转移的关键驱动因素,在肿瘤免疫逃避和免疫治疗耐受中起着关键作用。
CSCs具有自我更新和分化的潜力,可以在低细胞数量的情况下促进和维持肿瘤的生长,它们必须首先克服免疫监视的强大屏障。研究人员推测部分CSCs能够逃避免疫细胞的检测和清除,逃避抗肿瘤免疫;然而,这种现象背后的具体机制在很大程度上仍然未知。

近日,来自北京协和医学院的研究者们在SignalTransductTargetTher杂志上发表了题为“Targetingcarnitinepalmitoyltransferase1A(CPT1A)inducesferroptosisandsynergizeswithimmunotherapyinlungcancer”的文章,该研究表明通过靶向CSCs的铁死亡代谢可提高肺癌免疫治疗的疗效,这是一种机制导向的治疗策略的潜力。
肿瘤干细胞(CSCs)已被确定为免疫治疗相关耐药的关键参与者。铁死亡是一种由铁依赖性脂质过氧化引起的细胞死亡形式,受细胞代谢重塑的高度调节,并已显示与免疫治疗联合使用时具有协同效应。CSCs的代谢适应驱动肿瘤抵抗,但其在肿瘤免疫逃避中的铁死亡防御机制尚不清楚。
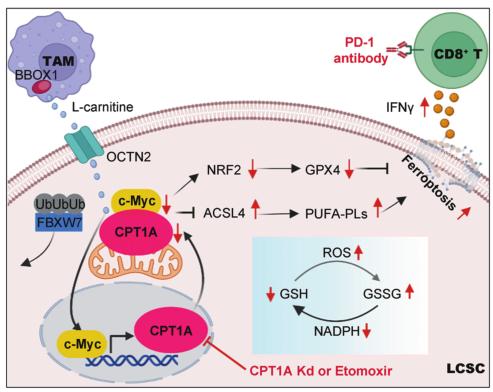
通过代谢组学、转录组学、肺上皮特异性CPT1A敲除小鼠模型和临床分析,研究者证明了CPT1A是脂肪酸氧化的关键限速酶,与来自肿瘤相关巨噬细胞的左旋肉碱一起作用,驱动肺癌中铁中毒抵抗和CD8+T细胞失活。
在机制上,CPT1A抑制c-Myc的泛素化和降解,而c-Myc转录激活CPT1A的表达。CPT1A/c-Myc正反馈回路通过激活NRF2/GPX4系统进一步增强细胞抗氧化能力,并通过下调ACSL4减少磷脂多不饱和脂肪酸的数量,从而抑制CSCs的铁死亡。值得注意的是,靶向CPT1A可增强荷瘤小鼠免疫检查点阻断诱导的抗肿瘤免疫和肿瘤铁死亡。
图片来源:https://doi.org/10.1038/s41392-024-01772-w
总之,本研究表明CPT1A对肺癌干细胞(LCSCs)的铁死亡抗性有显著影响,驱动复杂的代谢重编程。此外,研究发现了CPT1A和c-Myc之间在LCSCs铁死亡过程中的一种新的反馈调节机制,揭示了代谢重连接如何在免疫清除过程中支持肿瘤细胞存活。这些发现为开发一种潜在的治疗策略提供了新的见解,该策略旨在破坏LCSCs中的铁死亡耐药性以抑制肿瘤进展,具有良好的临床意义。
参考文献
LeiMaetal.Targetingcarnitinepalmitoyltransferase1A(CPT1A)inducesferroptosisandsynergizeswithimmunotherapyinlungcancer.SignalTransductTargetTher.2024Mar7;9(1):64.doi:10.1038/s41392-024-01772-w.
