Blood: 科学家重要发现或为镰状细胞病等血液疾病提供治疗新靶点
转自:泰格医药
血红蛋白(hemoglobin,Hb)是存在于几乎所有脊椎动物红细胞中的含铁氧转运蛋白,血液中的血红蛋白将氧气从呼吸器官输送到机体的其他部位,为新陈代谢提供能量。
血红蛋白不止一种,根据四个亚基组成的不同,血红蛋白可以被分为多种类型,血红蛋白A(HbA)是成人最常见的血红蛋白类型,正常情况下占比超过95%。有趣的是,人体内不同血红蛋白的比例并非一成不变,在胎儿时期,人体内最常见的是胎儿血红蛋白,也就是血红蛋白F(HbF),HbF具有更强的氧结合能力,它在出生后表达水平才逐渐降低,被HbA取代。HbF和HbA结构上略有差异,HbF由一对α链和一对γ链组成,而HbA由一对α链和一对β链组成。
在镰状细胞病和β地中海贫血等疾病状态下,HbF水平也会代偿性增加,而通过增加HbF来治疗这类血红蛋白病已经成为一种有希望的新疗法。因此,搞清楚人类从HbF到HbA的基因表达转变过程对进一步了解和治疗疾病有着重要意义。
多梳家族蛋白PcG是一组进化保守可以修饰组蛋白的蛋白。PcG包括两种多梳抑制复合物(Polycomb-repressivecomplex,PRC),PRC1与PRC2。近期发表在Blood杂志上的一篇论文利用CRISPR筛选技术鉴定到了一种HbF表达抑制因子BMI1,其作为PRC1的重要组分,通过调控下游RNA结合蛋白LIN28B、IGF2BP1、IGF2BP3抑制了HbF表达[1]。

研究者在低表达HbF的人类脐带血来源的红系祖细胞2(HUDEP2)中进行CRISPR筛选,他们建立了一个针对453种E3连接酶亚基和其他活性基团的sgRNA文库,平均每个基因有6个sgRNA。将HUDEP2细胞按照HbF表达水平分离,在表达最高的10%中,靶向PRC1亚基之一的BMI1(即PCGF4)的6个sgRNA均富集,说明BMI1是HbF表达的抑制因子。
缺失BMI1的HUDEP2细胞能够正常生长并分化,但相较对照表达HbF的细胞数量提升5倍。进一步分析发现,缺失BMI1细胞中,表达HbA的α亚基和β亚基的HBA和HBB基因mRNA水平不变,而表达HbF的γ亚基的γ-珠蛋白基因(HBG1/2)mRNA水平升高。显然,BMI1缺失在HUDEP2细胞中特异性激活HBG1/2转录。
在原代成红血细胞(primaryadulterythroblasts),BMI1缺失同样可以增加HbF表达。研究者还观察到HBB和HBA的表达轻微增加,研究者认为,这是细胞加速分化和减缓增殖带来的。于此相对的,HBG1/2表达增加更为显著,可以认为是BMI1缺失的结果。
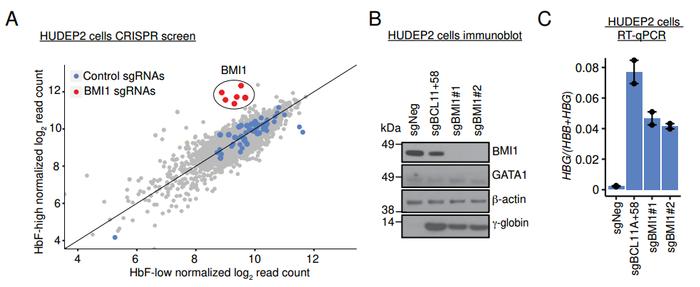
为了寻找下游机制,研究者对缺失BMI1的HUDEP2细胞进行RNA测序,共找到346种表达改变超过2倍的基因,其中306种表达上调、40种表达下调。与前述实验结果一致,HBG1/2表达上调16倍,而胚胎血红蛋白常见的ζ亚基基因HBZ表达上调28倍。这说明BMI1可能同时抑制胚胎和胎儿常见的血红蛋白基因表达。
此外,BMI1缺失导致了两种表达RNA结合蛋白的基因LIN28B、IGF2BP1显著激活。这两种基因在胎儿红系细胞中广泛表达[2],且此前被证实在成人红系细胞内过表达可促进HbF产生[3]。LIN28B和IGF2BP1的已知共同靶点GCNT2也在BMI1缺失HUDEP2细胞中下调。基因富集分析(GSEA)显示,BMI1缺失HUDEP2细胞中胎儿红系细胞特异性转录本上调,研究者认为,这是由LIN28B和IGF2BP1增加导致的对胎儿基因表达的整体影响[4]。
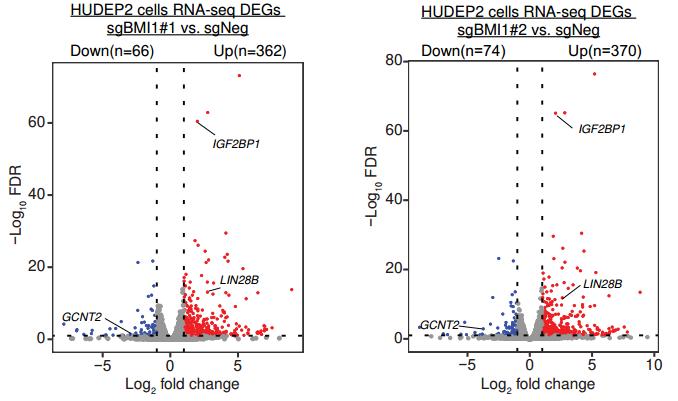
此前研究发现,LIN28B和IGF2BP1通过干扰BCL11AmRNA转录激活HBG[3],本研究中通过内源性表达BCL11A很大程度上恢复了BMI1缺失细胞中的HBG抑制。这说明BCL11A也是BMI1调控HbF的一环。
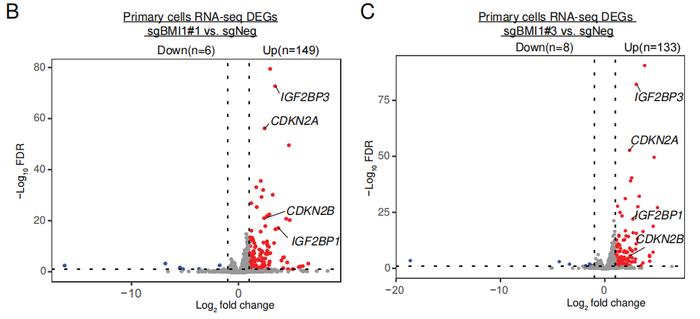
研究者在原代成红血细胞也进行了RNA测序,发现BMI1缺失后两种延缓细胞周期的基因CDKN2A和CDKN2B表达增加,但在HUDEP2细胞中二者表达水平并未改变,这与前述实验中HUDEP2细胞在缺失BMI1后仍可继续生长一致。
有趣的是,BMI1缺失成红血细胞中并未检测到LIN28B表达改变,而是IGF2BP1和其同源物IGF2BP3表达上调10倍有余。单独表达IGF2BP1或IGF2BP3都能够以剂量依赖的形式增加HBG表达。这证实在成红血细胞中调控BMI1缺失后HbF增加的不是LIN28B和IGF2BP1,而是IGF2BP1和IGF2BP3。即考虑到不同发育阶段,LIN28B、IGF2BP1/3共同介导了BMI1的HbF表达抑制。
研究者进一步分析了BMI1及下游的LIN28B和IGF2BP1/3干扰HbF表达的机制。他们发现,BMI1作为PRC1组分与PRC2协同作用,对LIN28B、IGF2BP1/3所在染色质进行沉默修饰。在胎儿肝脏、脐带血、外周血的原代幼红细胞中进行的分析可以发现,随着人类发育,这种表观遗传沉默逐渐增强,这与既往研究观察到的随胎儿到成人发育过程中LIN28B、IGF2BP1/3表达沉默、组蛋白翻译后修饰改变是一致的[5]。
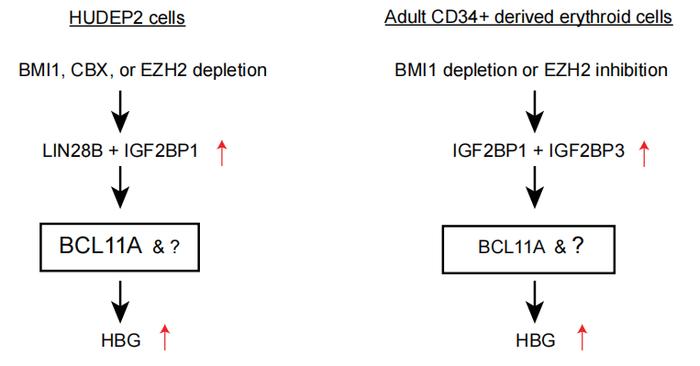
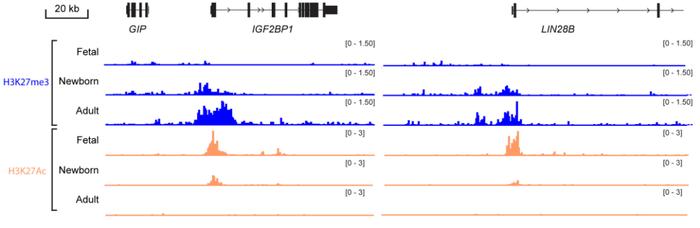
这项研究发现了人类发育过程中从HbF到HbA转变的关键机制,强调了PRC过程在其中的作用,并找到了几个关键的靶点。此前,一种PRC2抑制剂FTX-6058已被证实可以提高HbF的产生,并开展了针对镰状细胞病的临床试验[6]。了解了更具体的分子机制,相信未来能够有更多针对相应靶点的新药出现。
参考文献:
[1] KunhuaQin,XianjiangLan,PengHuang,MeganS.Saari,EugeneKhandros,CherylAKeller,BelindaM.Giardine,OsheizaAbdulmalik,JunweiShi,RossC.Hardison,GerdA.Blobel;Molecularbasisofpolycombgroupprotein-mediatedfetalhemoglobinrepression.Blood2023;blood.2022019578.doi:https://doi.org/10.1182/blood.2022019578
[2] ZhouD,LiuK,SunCW,PawlikKM,TownesTM.KLF1regulatesBCL11Aexpressionandγ-toβ-globingeneswitching.Nat.Genet.2010;42(9):742–744.
[3] BasakA,MunschauerM,LareauCA,etal.ControlofhumanhemoglobinswitchingbyLIN28B-mediatedregulationofBCL11Atranslation.Nat.Genet.2020;52(2):138–145.
[4] YuanJ,NguyenCK,LiuX,KanellopoulouC,MuljoSA.Lin28breprogramsadultbonemarrowhematopoieticprogenitorstomediatefetal-likelymphopoiesis.Science.2012;335(6073):1195–200.
[5] HuangP,KellerCA,GiardineB,etal.Comparativeanalysisofthree-dimensionalchromosomalarchitectureidentifiesanovelfetalhemoglobinregulatoryelement.GenesDev.2017;31(16):1704–1713.
[6] StuartB,BrunoP,PolioudakisD,etal.P1498:InhibitionofPolycombRepressiveComplex2ThroughEedInducesFetalHemoglobininHealthyandSickleCellDiseaseModels.HemaSphere.2022;6:1380–1381.
