研究揭示T细胞抗原刺激信号放大与衰减机制
7月4日,《美国国家科学院院刊》(PNAS)在线发表了中国科学院分子细胞科学卓越创新中心许琛琦研究组、生物物理研究所娄继忠课题组,以及浙江大学医学院陈伟课题组合作完成的最新研究成果(Self-programmeddynamicsofTcellreceptorcondensation)。该工作发现了T细胞受体(TCR)通过内置的基于CD3ε/Lck的一套自编程的聚集以及解聚的机制来调控T细胞激活,从相分离的角度阐释了TCR信号通路敏感性以及快速性的分子机制,并进一步丰富了TCR基于Csk的负调控机制。
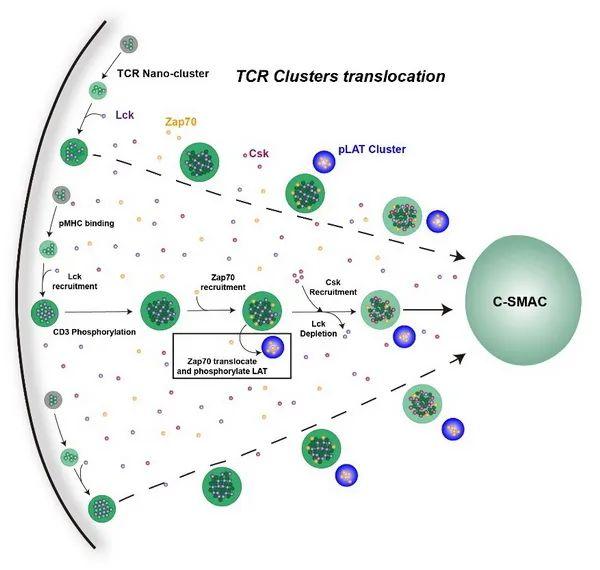
T细胞是适应性免疫的重要组成部分。TCR复合体作为T细胞膜表面最关键的膜受体,可以识别抗原并介导T细胞激活。TCR复合体有4种CD3信号链(CD3g/d/e/z),共携带20个酪氨酸位点。不同的抗原刺激会引起不同的磷酸化模式,从而产生不同的免疫应答。许琛琦团队致力于T细胞的信号转导及功能调控研究。该团队前期研究发现,在静息状态时,CD3e链和CD3z链的碱性氨基酸富集区(BRS)通过和细胞膜上酸性磷脂发生静电作用,使得ITAM基序被保护起来,免于被下游激酶磷酸化。T细胞活化初期,内流的Ca2+通过中和酸性磷脂所带的负电荷,帮助TCR复合物的胞内段从细胞膜上解离下来,从而发生磷酸化。酪氨酸激酶Lck具有明显的底物选择性,其UD结构域和CD3e链胞内区的BRS序列发生静电相互作用,从而高效介导磷酸化过程。而磷酸化的CD3e链可以通过其ITAM信号基序招募抑制性激酶Csk来负向调控TCR信号强度,使TCR信号能够维持在合适水平。
研究利用体外重组二维膜系统(SLB)对TCR的四种CD3亚基胞内域进行筛选,发现只有CD3ε亚基的胞内域可以与Lck在二维膜上发生相分离。CD3ε亚基胞内域的BRS序列以及Lck的UD结构域对于两者的相分离十分重要。研究通过体外重组液滴以及细胞激活实验发现,相分离不仅增强了CD3ε以及CD3ζ胞内域的磷酸化,而且进一步促进了Lck的激活,且这种自我促进的相分离系统可以帮助T细胞仅凭少量的TCR激活即可快速活化。结合前期数据,研究发现磷酸化的CD3ε可以招募抑制性激酶Csk,而Csk的竞争性结合导致Lck被排出CD3e/Lck相分离。同时,Csk可以使活化的Lck回到非活化状态,进而抑制T细胞的过度活化。
研究工作得到国家自然科学基金、中国科学院战略性先导科技专项(B类)、国家重点研发计划等的支持。浙江大学医学院第一附属医院等的科研人员参与研究。相关荧光成像工作在生物物理所生物成像中心完成。