MedComm | 杨贝/陈佳/杨力/陆路合作揭示基因编辑技术在传染性疾病防治方向的应用
转自:生物谷
近日,上海科技大学免疫化学研究所杨贝课题组、生命科学与技术学院陈佳课题组与复旦大学杨力课题组、陆路课题组合作在国际学术期刊MedComm上发表题为“Primeeditor-mediatedfunctionalreshapingofACE2preventstheentryofmultiplehumancoronaviruses,includingSARS-CoV-2variants”的研究论文,报道了通过对冠状病毒的受体ACE2基因进行导向编辑(primerediting)介导的功能性重塑,可以在不影响ACE2正常生理功能的情况下,实现广谱抑制包括新冠病毒在内的多种人冠状病毒的效果。该研究初步探索了导向编辑技术在传染性疾病防治方向的应用潜力,也展现了对宿主受体开展精准性功能改造策略的广谱性优势。
自新冠疫情爆发以来,SARS-CoV-2病毒感染已造成全球近700万人死亡。对抗新冠这样的传染性疾病,疫苗接种是预防感染最主要的策略之一。然而,SARS-CoV-2病毒在持续的传播和群体免疫选择压力下不断进化,传播性和免疫逃避能力增强的新变种不断出现,使得现有疫苗预防感染的效果不断降低。事实上,包括Alpha、Beta、Gamma、Delta和Omicron在内的不同SARS-CoV-2主流变种(VOCs)已陆续在全球范围内引起多次感染高峰。同时,全球数百万免疫系统受损的人群也可能无法从疫苗接种获得足够的保护。因此,针对SARS-CoV-2感染探索新型预防策略具有科学意义。
病毒感染依赖于病毒蛋白和宿主因子之间的一系列相互作用。因此,抗病毒策略既可以靶向病毒蛋白,也可以针对宿主因子。而与不断进化的病毒蛋白相比,靶向宿主因子的抗病毒策略具有更强的病毒进化抵御力,甚至可以达到广谱抑制不同病毒的效果。例如,人体内的血管紧张素转化酶2(ACE2)是SARS-CoV-2、SARS-CoV以及HCoV-NL63等多种冠状病毒的共同受体,靶向宿主因子ACE2的抗病毒策略将有望同时阻断上述不同病毒对于宿主细胞的入侵。然而,绝大多数宿主因子都具有重要的生理功能。因此,精准改造宿主因子以阻止其被病毒利用、同时又保持其正常生理功能是宿主靶向策略成功的关键,而这一策略难以通过传统的小分子药物或更适合于基因敲除的编辑工具(如CRISPR/Cas核酸酶)来实现。此前,杨贝课题组与陈佳课题组、杨力课题组等合作,共同开发、优化了一系列新型基因编辑工具(NatBiotechnol,2018a;NatBiotechnol,2018b;CellRep,2020;NatCellBiol,2021;NatCommun,2022),同时杨贝课题组与陆路课题组合作,曾在广谱抗冠状病毒抑制肽的开发(SciAdv,2019)以及对α属冠状病毒刺突蛋白的抗原图谱描绘等方向开展深入研究(CommunBiol,2022)。在上述长期合作的研究基础上,杨贝课题组、陈佳课题组、杨力课题组和陆路课题组组成的联合研究团队进一步探索了利用可在基因组中精准诱导所有类型的碱基替换和小片段插入或缺失的新型导向编辑器(PrimeEditor)执行上述宿主靶向策略的可行性与有效性。
根据不影响ACE2受体在维持血管收缩/舒张平衡以及控制血压方面的生理功能、只阻断其与多种冠状病毒蛋白互作的原则,联合研究团队首先在结构信息的指导下选择了潜在的氨基酸编辑位点,并对所选位点开展了编辑效率的筛选(图1A)。进一步,联合研究团队在生化、细胞及假病毒、活病毒等不同水平对具有较高编辑效率的位点及其组合开展了编辑效果的验证(图1B)。结果表明,对ACE2蛋白Q24/D30/K31和/或K353残基的特定编辑可以完全阻断ACE2与SARS-CoV-2及其所有主流变种、SARS-CoV以及HCoV-NL63的结合,进而抑制它们入侵宿主细胞,而不影响ACE2的正常生理功能(图1C)。该研究为基于导向编辑技术的宿主因子功能重塑策略提供了基础性探索和初步的概念验证,为病毒感染性疾病的广谱防治提供了新方法和新思路。
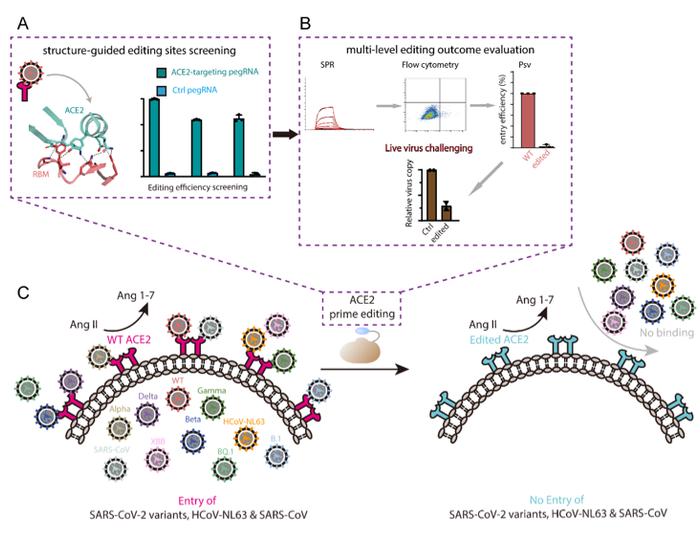
图1、导向编辑器(PrimerEditor)介导的人ACE2受体功能重塑。A、结构指导的基因编辑位点筛选;B、在生化、细胞、病毒等不同水平验证基因编辑对于ACE2受体的功能改造效果;C、编辑后的ACE2保有正常生理功能,但不再具有介导包括新冠病毒在内的多种人冠状病毒入侵宿主细胞的能力。
文章链接:https://doi.org/10.1002/mco2.356
